
18.各取等体积碱液少许,加水稀释相同倍数(如100倍),然后用pH试纸检验,pH变化大的为强碱溶液。
讲析:利用加水稀释过程中,强电解质和弱电解质溶液中离子浓度的变化程度不同这一特点可解决问题。稀释过程中,因弱电解质继续电离,所以在稀释相同倍数时,强电解质溶液中离子浓度的减小程度明显大于弱电解质。
16.C 17. AD
讲析:16.由于Ba(OH)2溶液的PH值为13,可求得它的物质的量的浓度为0.05mol/L,所以它的物质的量=0.05×0.06=0.003mol,从Ba(OH)2与磷酸的反应关系式3Ba(OH)2-2H3PO4可知,要使它与磷酸反应成中性,共需磷酸的物质的量为0.002mol,当PH值为P时,从图中可以看出消耗的磷酸的物质的量为总量的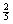 ,却0.002×
,却0.002×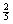 =0.0008mol,生成Ba3(PO4)20.0004mol,质量为0.24g。
=0.0008mol,生成Ba3(PO4)20.0004mol,质量为0.24g。
9.C 10.C 11.B 12.D 13.D 14.D 15.A
1.CD 2.AC 3.B 4.D 5.D 6.C 7.C 8.AD
4.(1)否,若a=3,则b=6,溶液显酸性,与题意不符,故a≠3
(2)否,若a=5,[H+]a=10-5mol·L-1,则b=10,[OH-]b = 10-4mol·L‑1
,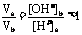 ,不符合题意,故a≠5
,不符合题意,故a≠5
(3)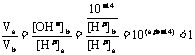
所以(a+b-14)<0,而a=0.5b
即3a<14,a<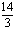
又pH=b=3a>7,a>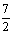 所以
所以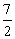 <a<
<a<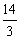
检测提高
1.CD 2.D 3.AC
讲析:1.pH=12的溶液,可能是碱溶液,也可能是盐溶液。忽略了强碱弱酸盐的水解,就会漏选D. 2.由水电离的H+浓度为1.0×10-13mol/L-1的溶液可能是酸或者碱溶液。3.HCl溶于水完全电离,而CH3COOH溶于水存在电离平衡:CH3COOH=CH3COO-+H+,加水该平衡向右移动,H+物质的量增大,需加更多的水才能与盐酸c(H+)相同;加CH3COONa时,c(CH3COO-)增大,上述平衡向左移动。c(H+)降低,pH变化大,而盐酸加NaCl后pH基本不变。故A、C符合题意。B只能说明盐酸和醋酸具有挥发性,D只说明c(H+)相同,速率相同,与醋酸是否完全电离均无关,故B、D不符题意。
14.(1)62.3kg (2)2.7 (3)82.2kg
第15课时 (B卷)
纠错训练
13.1000 mL,81.8 mL ,大于81.8 mL , 0<V2≤81.8
9.CD 10.C 11.AD 12.D
讲析:5.因为pH相同的强酸和弱酸等倍稀释时,弱酸的pH小,所以如果稀释后的pH要相同,弱酸的稀释倍数要大,所以a>b 7.强酸中c(H+)=10-amol·L-1,强碱中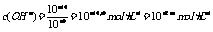 1,混合后pH=7,即n(H+)=n(OH-),故V(碱)=102V(酸)
1,混合后pH=7,即n(H+)=n(OH-),故V(碱)=102V(酸)
1.D 2.C 3.D 4. CD 5.D 6.B 7.B 8.B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com