
2.两溶液恰好完全反应后得到甲酸钠溶液,由于甲酸根的水解,HCOO-的浓度比Na+的浓度变小,溶液呈碱性,故应选A。 3. NaHSO4是强酸的酸式盐,可以不考虑水解。其余的盐都要考虑盐的水解
1.B D 2.A 3.C
讲析:1.此题实质上是0.05mol/L的HCN溶液和0.05mol/L的NaCN溶液的混合溶液。由电荷守恒关系可得:
c(H+)+c(Na+)=c(CN-)+c(OH-) (1) 由于c(OH-)﹥c(H+)可知B选项正确
由物料守恒关系可得:
c(HCN)+c(CN -)=c(Na+)×2=0.01mol/L (2)
(2)可知D正确。且c(Na+)>c(CN-)即c(HCN) ﹥c(Na+)>c(CN-),所以A选项错。
将(1)×2+(2)可得:
2c(H+)=c(CN -)+2c(OH-)-c(HCN) (3)
C选项错误。
26.(1999年全国高考)二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A=H++HA-, HA-=H++A2-已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(1)c(H+)最大的是 ,
最小的是 。
(2)c(H2A)最大的是 ,
最小的是 。
(3)c(A2-)最大的是 ,
最小的是 。
25.在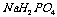 溶液中存在的平衡有(用离子方程式表示):____________________
_。
溶液中存在的平衡有(用离子方程式表示):____________________
_。
设计一实验说明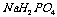 的电离程度比水解程度大_________________________
。
的电离程度比水解程度大_________________________
。
24.浓度相同的下列各种溶液PH值由小到大的顺序是:________ __。
①HNO3 ②H2SO4 ③H2CO3 ④KOH ⑤Ba(OH)2 ⑥Na2CO3 ⑦KNO3 ⑧AlCl3 ⑨CuCl2
23.在常温的条件下:为了表示弱电解质的相对强弱,把溶液种已电离的电解质分子数占原来总分子数的百分数称作电离度。设某pH值的硫酸溶液中水的电离度为α1,相同pH值的硫酸铝溶液中水的电离度为α2, 那么α1和α2的数值相比较,α1 α2。(填“>”“<”“=”)
某硫酸和硫酸铝两种溶液的pH值都是3,那么硫酸中水电离出的c(H+)是硫酸铝中水电离的c(H+)的 倍。
若设某pH值的硫酸中水电离出的c(H+)=1.0×10-amol/l,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-bmol/l,(a、b都是小于14的正数),那么a、b之间 满足的关系式是 、
(用一个等式和一个不等式表示)。
22.在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)与c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为_______同学的说法正确,理由是__________________________________。
21.现有电解质溶液:①Na2CO3②NaHCO3③NaAlO2④CH3COONa
⑤NaOH 且已知:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32-
①当五种溶液的pH相同时,其物质的量浓度由大到小的顺序 (填编号,下同)
②将上述物质的量浓度均为0.1mol/L的五种溶液,稀释相同倍数时,其pH变化最大的是
③在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是
④将上述①②③这三种电解质溶液混合,发生反应的离子方程式为
20.BiCl3水解生成BiOCl。
⑴写出水解方程式 。
⑵医药上把BiOCl叫做次氯酸铋。你同意此名称吗?
(填“是”或“否”)理由
。
⑶如何配制BiCl3溶液?
。
⑷把适量固体BiCl3置于浓NaCl溶液中可得澄清液,请说出可能的原因
。
19.0.1mol/L Na2CO3溶液中,三种阴离子物质的量浓度由大到小的顺序为:____>____>____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com