
2.金属腐蚀与防护
化学腐蚀与电化腐蚀
|
|
化学腐蚀 |
电化腐蚀 |
|
含义 |
金属或合金直接与具有腐蚀性的化学物质接触发生氧化还原反应而消耗的过程 |
不纯金属或合金与电解质溶液接触发生原电池反应而消耗的过程 |
|
得失电子 |
金属直接将电子转移给由氧化性的物质 |
活泼金属将电子间接转移给氧化性较强的物质 |
|
电流 |
无电流产生 |
由微弱的电流产生 |
|
腐蚀现象 |
金属单质 |
较活泼金属 |
|
事例 |
金属与O2、Cl2等物质直接反应 |
钢铁在潮湿的空气中倍腐蚀 |
1. 理解原电池的原理
(1)原电池的定义:把化学能转化为电能的装置叫原电池。
(2)构成条件:
①活泼性不同的两电极②电解质溶液③具有闭合回路
(3)工作原理(电子流向)
较活泼的金属材料作为负极,失去电子,经外电路流向较不活泼金属,再经电解质溶液回到负极,构成闭合回路,电流反向流动
(3)正、负极判断:
负极:电子流出的电极,为较活泼金属电极,发生氧化反应
正极:电子流入的电极,为较不活泼金属或非金属或金属氧化物,发生还原反应
(4)电极反应
电极反应 本质 现象
负极 Zn-2e-=Zn2+ 氧化反应 溶解
正极 2H++2e-=H2↑ 还原反应 气泡
总反应 Zn+2+= Zn2++H2↑
(5)用:①制各种电池;②判断反应速率;③判断金属的活泼性;④金属防护。
26.(1)A D (2) C D (3)D A
讲析:反应后的C溶液为:0.01 mol·L-1H2A、0.01 mol·L-1 NaHA和0.01 mol·L-1 NaCl的混合液。因HA-的存在抑制了H2A的第一步电离,所以c(H+)小于A溶液中c(H+),但c(H2A)大于A溶液c(H2A)。反应后D溶液为0.01 mol·L-1的Na2A溶液,所以c(A2-)最大,但因其水解,c(H+)最小。
25.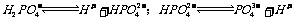
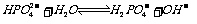
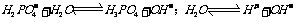
取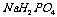 溶液,用
溶液,用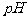 试纸测溶液的
试纸测溶液的 ,得
,得 ,说明
,说明 的电离程度大于其水解程度。
的电离程度大于其水解程度。
24. ②①③⑨⑧⑦⑥④⑤
23. < 10-8 a+b=14 b>7>a
22.甲同学正确,根据电荷守恒原理,c(M+)+c(H+)=c(A-)+c(OH-),因溶液呈中性,即c(H+)=c(OH-),所以(M+)=(A-)。
21. (1)④>②>①>③>⑤ (2) ⑤ (3) ③④⑤
(4)
20.(1)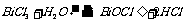
(2)不同意,因BiOCl中Cl为-1价而不是+1价
(3)将BiCl3溶解于含适量HCl得蒸馏水中
(4)增大溶液中Cl-浓度,抑制了BiCl3得水解
19. c(CO32-) c(OH-) c(HCO3-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com