
0.1mol 0.1mol 0.2mol 0.1mol 0.4mol
0.1mol 0.2mol 0.1mol 0.4mol
故V(气体)=V(Cl2)十V(O2)=2.24L十2.24L=4.48L。
电解后c(H+)≈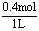 =0.4mol/L,
=0.4mol/L,
pH=-lg c(H+)=1-2lg2。
新活题网站
4.惰性电极时,依据阴、阳离子放电顺序书写电极反应,阳极:先2C1--2e=Cl2↑,后4OH--4e=O2↑+2H2O。在阳极附近,因OH-放电而促进了水的电离平衡右移,溶液酸性明显增强。由电子守恒关系:
C12 - Cu,另析出0.2mol Cu,2Cu - O2 - 4H+。
3.B 讲析:电解饱和的氯化钠溶液的化学方程式:

 ,为使Cl2被完全吸收,制得较强杀菌能力的消毒液,与电源b极相连的电极应为阳极,产生氯气,与溶液充分反应,反应式为:
,为使Cl2被完全吸收,制得较强杀菌能力的消毒液,与电源b极相连的电极应为阳极,产生氯气,与溶液充分反应,反应式为:
Cl2+2NaOH=NaClO+NaCl+H2O
2.(1)正 (2)2NaCl+2H2O=H2↑+Cl2↑+2NaOH
(3)Zn-2e = Zn2+, Zn2++2e = Zn,ZnSO4溶液或ZnCl2溶液
1. D 讲析:电解H2SO4、Na2SO4、NaOH溶液都是电解水,溶质的浓度应相应的变化
14.呈现红色的部位发生了2H++2e = H2,而导致H+浓度下降,致使[OH-]>[H+],所以A是负极,B是正极
15. 负极:答:Zn-2e = Zn2+、反应类型:氧化反应;
正极:2NH4++2e = 2NH3+H2、反应类型:还原反应 16.甲溶液的PH值大于乙溶液的PH值。甲:Fe-2e = Fe2+(负极)、2H2O+O2+4e = 4OH-(正极);乙: Fe-2e = Fe2+(负极)、2H++2e = H2(正极)
13.是钾、B是铜、C是银、D是铁、E是锌、F是铂、G是锡
12.(1)电化学腐蚀;铁锅材料为铁合金,其中铁和少量碳及NaCl残液构成原电池。(2)2Fe-4e-=2Fe2+(2分);2H2O+O2+4e-=4OH-;
Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe(OH)3+(n-3)H2O=Fe2O3·nH2O
11. O2+2CO2+4e 2CO32-,2CO+O2 2CO2
1.AD 2.B 3.C 4.D 5.C 6. B 7.BD 8.D 9.D 10.D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com