
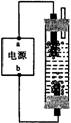
2.(2002高考试测题)右图A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
(1)电源A的a为 极。
(2)滤纸B上发生的总反应方程式为:
。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为 ,
电极f上发生的反应为: ,槽中盛放的镀液可以是 或 (只要求填两种电解质溶液)。
(本题考查学生判断电解池的阴、阳极,书写电极反应式总反应方程式)
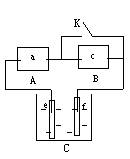
 3.(2002上海高考)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
3.(2002上海高考)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A a为正极,b为负极;NaClO和NaCl
B a为负极,b为正极;NaClO和NaCl
C a为阳极,b为阴极;HClO和NaCl
D a为阴极,b为阳极;HClO和NaCl
(本题考查电解原理及其应用,是一道包括电极判断、实验观察、综合分析能力在内的综合题)
1.(2003全国高考江苏卷)用惰性电极实现电解,下列说法正确的是 ( )
A 电解稀硫酸溶液,实质上是电解水,故溶液p H不变
B 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C 电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
 (本题考查电解产物和溶液pH的计算)
(本题考查电解产物和溶液pH的计算)
2.电解原理的应用
(1)电解饱和食盐水制取氯气和烧碱:
食盐水中一般混有Mg2+、Ca2+、SO42-等离子,电解前须净制以除去这些杂质离子电极材料
电极反应式:阳极(石墨): 2Cl--2e-=Cl2↑
阴极(钢铁):2H++2e-=H2↑
总反应为:2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(2)电镀:①电极:阳极-镀层金属 阴极-待镀金属(镀件) 电镀液- 含有镀层金属离子的溶液 ②电镀特点:阳极本身参加了反应,而电镀过程中电镀液的浓度
(3)精炼铜
以精铜作阴极,粗铜作阳极,电解硫酸铜水溶液,阳极粗铜溶解,阴极析出铜,电解液浓度基本不变。
典型题点击
1.理解电解原理
(1)电解的定义:将电能转化为化学能的装置
(2)电解池中的阴、阳极判断:
阳极:与电源正极相连的极,在阳极上发生氧化反应。
阴极:与电源负极相连的极,在阴极上发生还原反应。
离子移向:阴离子移向阳极,阳离子移向阴极
(3)电解时电极产物的判断
①阳极产物判断
首先看电极,如果是活性电极(金属活动顺序表Ag以前),则电极材料失电子,电解时电极溶解,溶液中的阴离子不能失电子。如果是惰性电极(如Pt、Au、石墨)则要看溶液中的离子的失电子的能力。此时根据阴离子放电顺序加以判断。
阴离子的放电顺序:S2->I->Br->Cl->OH->含氧酸根
②阳极产物判断
直接根据阳离子放电顺序进行判断,阳离子的放电顺序为:
Ag+>Hg2+>Fe3+>Cu2+>Pb2+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+>Ca2+>K+
13.①Q=I·t=216×103C 相当于2.24mol e
相当于2.24mol e 相对于有1.12mol水被电解了(20.1g水)②从剩余溶液总质量164.8g,知有200g-164.8g=35.2g物质离开溶液,其中有20.1g水被电解,由此可知
相对于有1.12mol水被电解了(20.1g水)②从剩余溶液总质量164.8g,知有200g-164.8g=35.2g物质离开溶液,其中有20.1g水被电解,由此可知 结晶的KOH·2H2O的质量为35.2g-20.1g=15.1g
结晶的KOH·2H2O的质量为35.2g-20.1g=15.1g 结晶的KOH的质量为:
结晶的KOH的质量为: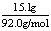 ×M(KOH)=9.2g
×M(KOH)=9.2g 结晶水的质量为:
结晶水的质量为: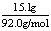 ×2M(H2O)=5.9g
×2M(H2O)=5.9g 剩余溶液的质量分数为:
剩余溶液的质量分数为: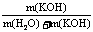 ×100%=55.1%
×100%=55.1%
③试题最终要求电解槽的温度。根据上面的计算结果,每100g溶液里有55.1g KOH,利用表知T应在20-30℃之间。现要求具体温度即不是温度范围,故有:利用此温度间的温度与溶解度呈线性关系,故:T=273-20-[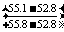 ×10]K=300.7K=27.7℃
×10]K=300.7K=27.7℃
12.(1)HCl
(2)
(3)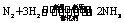
11.(1)CuCl2水解;Cu2++2H2O Cu(OH)2+2H+,使溶液呈酸性。(2)电解时,Cu2+可在阴极放电析出Cu,随c(Cu2+)降低,Cu2+的水解平衡左移,导致溶液中c(H+)下降,溶液的升高。(3)溶液的PH降低 因阳极上产生Cl2,一部分Cl2溶于水后发生反应:Cl2 +H2O
Cu(OH)2+2H+,使溶液呈酸性。(2)电解时,Cu2+可在阴极放电析出Cu,随c(Cu2+)降低,Cu2+的水解平衡左移,导致溶液中c(H+)下降,溶液的升高。(3)溶液的PH降低 因阳极上产生Cl2,一部分Cl2溶于水后发生反应:Cl2 +H2O H++Cl-+HClO,故使溶液中c(H+)增大(主要矛盾),即溶液PH降低。
H++Cl-+HClO,故使溶液中c(H+)增大(主要矛盾),即溶液PH降低。
10. (1)E接D、C接A、B接F F→B→A→C→D→E (2)2Cl--2e=Cl2↑ 变蓝色
Cl2+2I-=2Cl-+I2↓ (3)①③④⑥ (4)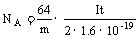
9.(1)64、2、3;(2)负;(3)1。
讲析:(1)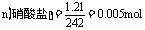 ,含金属M也为
,含金属M也为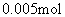 。M的原子量
。M的原子量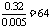 。
。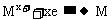
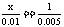 解得:
解得: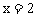 188 + 18 n =242,n = 3。(2) 因为金属在A极析出,所以A极是电解池的阴极,则C极是电源的负极。
188 + 18 n =242,n = 3。(2) 因为金属在A极析出,所以A极是电解池的阴极,则C极是电源的负极。
(3)有0.01mol电子通过电极,就有0.01mol OH-放电,在溶液中就生成0.01mol H+。
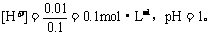
8.(1)先析出白色沉淀,后溶液变蓝。H2SO3+H2O+Ba2+-2e-==BaSO4↓+4H+;2I--2e-==I2 。(2)2HI== H2↑+I2 (3)SO2(H2SO3)的还原性显著比I-强,故前者在阳极上优先氧化,且因存在Ba2+而更易氧化。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com