
2.反应原理掌握不透,错误地认为实验室制氯气可以根据盐酸的量来计算生成氯气的量。MnO2只有与浓盐酸才反应,随着反应的不断进行,盐酸越来越稀,反应将会停止。
1.误认为干燥的Cl2有漂白作用。其实潮湿的Cl2才有漂白性,而真正起作用的应该是HClO,次氯酸盐氧化性很强也有漂白性在酸性条件下性能更强,也是生成HClO的缘故。
10.今有H2、Cl2的混合气体100mL(标准状况下),其中一种气体体积是45 mL,另一种气体体积是55 mL。光照使两种气体发生反应后恢复到标准状况下,气体体积为 mL。为证明反应后气体中H2或Cl2有剩余,使气体通过10 mL水,并使剩余气体干燥后再恢复到标准状况。若 (1)剩余 mL,证明有 剩余。
(2)溶液有 性质,证明有 剩余。
(本题是简单的过量计算及判断,根据气体定律来计算,并由物质性质确定什么有剩余。)
第20课时 氯气 (B)卷
易错现象
9.将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现。这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出。
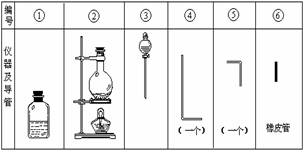
根据要求填写下列空白:
(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是 。
(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是 。
(3)仪器①的橡皮塞上应有 个孔,原因是
。
(4)实验时,仪器①中除观察到红光外还有
现象。
(5)实验需用约10%的H2O2溶液100毫升,现用市售30%(密度近似为1g/cm3)的H2O2来配制,其具体配制方法是
。
(6)实验时仪器①中ClO-与H2O2反应的离子方程式是:
。
(本题是综合实验题,考查实验室制备氯气的装置连接、新情境实验中的现象分析、溶液的简单配制以及离子方程式的书写等。灵活运用所学知识并结合信息加以分析,答题时语言要简洁流畅。)
8.用滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH(aq)中,当滴到最后一滴时红色突然褪去。试回答下列问题:
(1)实验室保存饱和氯水的方法是
。
(2)产生上述现象的原因可能有两种(简要的文字说明)
①是由于
;②是由于
。
简述怎样用简单实验证明红色褪去的原因是①还是②
。
7.漂白粉(又称漂粉精)主要成分可用下式表示:Ca(OH)2·3CaCl(ClO)·nH20,用过量的盐酸和漂白粉作用可生成氯气。Cl2与漂白粉的质量比叫做漂白粉的“有效氯”。现有一种漂白粉的“有效氯”为0.35,则式中的n值约为 ( )
A.6.5 B.8
C.8.5 D.10
(本题考查了关系式计算,利用题给信息和有关氧化还原反应的知识,找出漂白粉与氯气之间的关系式,再进行计算。)
6.氯气是有毒的,曾被法西斯制成毒气弹用于侵略战争。当这种毒气弹顺风爆炸时,通常可用的防御方法是 ( )
A. 人、畜应躲到低洼的地方。
B. 人、畜应到较高的地方去。
C. 人、畜应多喝豆浆和牛奶。
D. 可用肥皂水浸湿软布蒙面。
(本题考查氯气的性质,解题时要注意肥皂水、豆
浆和牛奶的性质区别。)
5.今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(m mol),在乙瓶中加入少量的NaHSO3晶体(m mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度大小关系是(溶液体积变化忽略不计) ( )
A.甲=乙>丙 B.甲>丙>乙
C.丙>甲=乙 D.乙>丙>甲
(本题考查氯水的成分、性质及平衡移动原理的运用,要熟悉相关知识并进行合理分析。)
4.用向上排空气法收集Cl2和HCl时,现可用于检验瓶中是否充满又可区别两种气体的一种试剂是( )
A.湿润的碘化钾淀粉试纸。
B.蘸有浓氨水的玻璃棒。
C.湿润的蓝色石蕊试纸。
D.湿润的红色石蕊试纸。
(本题考查HCl、Cl2的鉴别,熟练掌握它们的性质是解题的根本所在。)
3.用氯气消毒的自来水配制下列溶液时,会使所得溶液变质的是 ( )
①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤FeCl2
A.只有②④ B.只有④⑤
C.只有①④⑤ D.全部
(本题实质是考查氯气的化学性质,要熟练掌屋。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com