
5.下列对氯气的描述中,不正确的是 ( )
A.在标准状况下,氯气的密度是3.17g·L-1
B.实验室不能用排水法收集氯气
C.液氯不导电,是非电解质;氯水能导电,是电
解质
D.不干燥的氯气遇二氧化硫,其漂白性能增强
4.aL标准状况下的H2、Cl2混合气体经光照,充分反应后,所得气体恰好使溶液中bmolNaOH完全转变为盐,则a、b的关系不可能 ( )
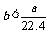
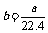
A. B.
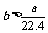
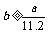
C. D.
D.
3.将0.2molMn02和50mLl2mol·L-1盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发)
( )
A.等于0.3 mol
B.小于0.3mol
C.大于0.3mol、小于0.6mol
D.以上结论都不正确
2.下列关于漂白粉的叙述中,正确的是( )
A.漂白粉的有效成分是Ca(C10)2和CaCl2
B.漂白粉在空气中久置后能变质
C.漂白粉的溶液呈碱性
D.在使用漂白粉时应用浓盐酸
1.市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性 ②使用时加水稀释③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是 ( )
A.Cl2 B.SO2
C.NaClO D.KMn04
3.现有用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(0H)2反应制少量漂白粉,现已知反应:
2Cl2+2Ca(OH)2=Ca(C10)2 +CaCl2+2H20(该反应放热)温度稍高即发生副反应:
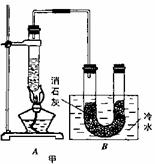
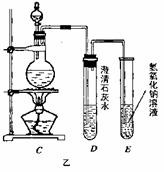 6C12+6 Ca(OH)2=5CaCl2+Ca(Cl03)2+6H2O。甲、乙、丙三人分别设计三个实验装置,如下图所示。
6C12+6 Ca(OH)2=5CaCl2+Ca(Cl03)2+6H2O。甲、乙、丙三人分别设计三个实验装置,如下图所示。
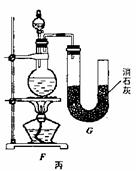
(1)请从,a不容易控制反应速率; b容易控制反应率; c有副反应发生;d可防止副反应发生; e污染环
境; f可防止污染环境;几个方面对上述甲、乙、丙三套装置的优缺点作出评析,并选择符合题目要求的选项填在空格内。
|
|
优点 |
缺点 |
|
甲装置 |
|
|
|
乙装置 |
|
|
|
丙装置 |
|
|
(2)上图中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置(填所选部分的编号) 。
(3)实验中若用1L12mol•l-1浓盐酸与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总小于0.15mol,其可能的主要原因是
。(假定各步反应均无反应损耗且无副反应发生)。
检测提高
2.1.8g某金属在氯气中燃烧后,质量增加了7.1g,该金属是 ( )
A.Ag B. Fe
C.Al D. Na
1.用1molMnO2和含HCl为4mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到的氯气
( )
A.等于2mol B.等于1mol
C.小于1mol D.大于2mol
4.不能充分、灵活应用氧化还原反应的知识。
纠错训练
3.对实验装置不够重视,没有环境保护意识,容易将装置错误连接,没有尾气吸收装置。实验室制氯气,往往混有HCl和H2O(气)等杂质,必须除去它们(先除HCl再干燥),氯气有剧毒,最后多余的氯气应用烧碱溶液吸收。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com