
8.(1)在阴凉处置于棕色试剂瓶中密封保存。(2)①氯水与NaOH反应生成两种盐,碱性减弱;②氯水过量后HClO的漂白性将溶液变成无色。向无色溶液中再滴加NaOH溶液,若不出现红色,应为原因②,若出现红色,应为原因①。
讲析:能使变红的酚酞褪色的原因可能是溶液碱性减弱(中和碱性)或氯水过量后HClO的漂白性将溶液变成无色。若设计实验证明褪色的可能原因,最简便的方法是在褪色的溶液中再滴加NaOH溶液,若不出现红色,说明是HClO漂白的结果,若出现红色,说明是中和碱性的结果。
1.D;2.B、D;3.D;4.C;5.B;6.B、D;7.C。
讲析:1.次氯酸盐具有强氧化性,有消毒杀菌作用。3.氯气与NaOH、NaBr、FeCl2作用显示氧化性。通入AgN03(aq),其实是先与水反应产生氯离子,再形成AgCl沉淀。通入Na2C03(aq),也是先与水反应产生酸,再产生CO2气体。 4.Cl2与湿润的碘化钾淀粉试纸变蓝,而HCl不能与之反应,不能检验HCl是否满瓶;Cl2与湿润的蓝色石蕊试纸先变红后褪色,HCl只能变红。用蘸有浓氨水的玻璃棒检验二者现象一样,均有白烟产生,用湿润的红色石蕊试纸不能检验HCl是否满瓶。5.Cl2+ H2O 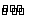 HCl+HClO,该反应是平衡体系,甲瓶中加入少量的NaHCO3晶体将会与HCl反应,平衡右移,c(HClO)增大;乙瓶中加入少量的NaHSO3晶体,HClO与之反应,c(HClO)减小,而丙中c(HClO)不变。 6.Cl2密度比空气大,且肥皂水水解显碱性与它反应。 7.HClO具有强氧化性,与反应生成Cl2: HClO+HCl=C12+H2O,则有下列关系式:
HCl+HClO,该反应是平衡体系,甲瓶中加入少量的NaHCO3晶体将会与HCl反应,平衡右移,c(HClO)增大;乙瓶中加入少量的NaHSO3晶体,HClO与之反应,c(HClO)减小,而丙中c(HClO)不变。 6.Cl2密度比空气大,且肥皂水水解显碱性与它反应。 7.HClO具有强氧化性,与反应生成Cl2: HClO+HCl=C12+H2O,则有下列关系式:
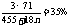 Ca(OH)2·3CaCl(ClO)·nH2O→3C1O-→3HClO→3C12,依题意:
,解得n=8.5
Ca(OH)2·3CaCl(ClO)·nH2O→3C1O-→3HClO→3C12,依题意:
,解得n=8.5
4.(1)2 4 2 2 1 2 H2O ;(2) ② ;
(3)0.2 ; (4)2.63 。
讲析:配平当然用化合价升降法,但必须分析一下本反应,符合“归中”规律,KClO3是氧化剂,ClO2是还原产物,HCl是还原剂,Cl2是氧化产物。而KCl中的氯来自盐酸(这部分盐酸起酸性作用!),缺少的产物一看便知是水。(2)、(3)也就容易了。解第(4)问不可忽视括号中的说明, 1molClO2作氧化剂(变成-1价氯)得5mole-,而1mol Cl2作氧化剂(变成-1价氯)得2mole-,故该答案为: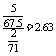 。
。
新活题网站
2.(1)2H++CO32-=CO2 ↑+H2O;
(2)CaCl2、Na2CO3、AgNO3、HCl。
讲析:从丁与乙混合产生无色气体,它们分别是Na2CO3、HCl中的一种,再从①、②信息中得出乙与甲、丙反应均有沉淀生成,确定乙为Na2CO3,丁是HCl。由于丙与丁、丙与甲作用都有沉淀,丙为AgNO3,甲是CaCl2。再代入检验一下,结论完全正确。
|
(2)
(3)Fe+2HCl==FeCl2+H2↑
(4)Cl2+2FeCl2==2FeCl3
讲析:B是黄绿色气体,说明B为Cl2,该题题眼就在此!C是无色气体,能与氯气反应,初步认定它是H2,则它们反应生成的E为氯化氢,E溶液为盐酸,盐酸与A反应又有氢气生成,说明A是金属。根据反应①、④推出A为Fe,代入验证,全部符合。
1.D
讲析: HCl与Cl2和干燥蓝色石蕊试纸、干燥有色布条均不作用,通入硝酸银溶液后,均能形成白色沉淀。Cl2与湿润的淀粉碘化钾试纸作用,先置换出I2,碘单质与淀粉变蓝,而HCl无此性质。
9.已知C12在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaCl03的物质的量之比为4:l。现有49.7 g C12,
将其通人到足量70℃的NaOH水溶液中,反应完全后得到500 mL溶液。
(1)写出C12在70℃的NaOH水溶液中符合上述条件的总反应方程式。
(2)计算完全反应后各生成物的物质的量浓度 (除H20外)。
8.G、Q、X、Y、Z均为氯的含氧化合物,它们在一定条件具有如下的转换关系(均未配平):
①G→Q+NaCl;

② Q+H2O X +H2;
③Y+NaOH→G+Q+H2O;
④Z+NaOH→Q+X+H20;
(1)这五种化合物中氯的化合价由低到高的顺序为:
;
(2)由反应②可看出Q、X中氯元素价态的高、低顺序,
所根据的理由是
;
(3)臭氧与二氧化氯作用,可得到红色油状的六氧化二氯(Cl206),遇有机物会爆炸。它与碱溶液反应可得到两种氯的含氧酸盐,代表该反应的是
(填①-④编号)。其离子方程式是:
;
(4)亚氯酸盐(如NaClO2)可用作漂白剂,在常温下不见光时可保存约1年,但在酸性溶液中因生成亚氯酸而发生分解:
5HCl02==4C102+H++Cl-+2H20
分解时,刚加入硫酸反应缓慢,随后突然反应迅速释放出气态的二氧化氯,这是因为 (填序号)。
A.酸使亚氯酸的氧化性增强
B.溶液中的H+起催化作用
C.溶液中的Cl-起催化作用
D.逸出ClO2使反应的生成物浓度降低
7.实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
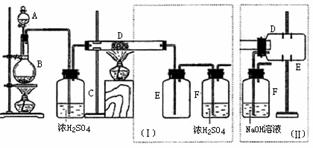
(1)B中反应的化学方程式为:
;
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是:
;
(3)D中反应化学方程式为:
;
(4)装置(Ⅰ)的主要缺点是:
;
(5)装置(Ⅱ)的主要缺点是: ;
如果选用此装置来完成实验,则必须采取的改进措施是:
。
6.实验室里用一般的气体发生装置来制备Cl2,反应物即使在停止加热后还会继续一段时间,当要收集多瓶Cl2时,常有较多的Cl2散到空气中去,为了避免Cl2的逸散,并对多余的Cl2随时取用,有人设计了如图甲装置来制取Cl2:

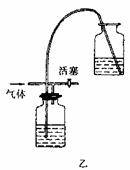
(1)设计甲装置是依据了 (填已学过的某仪器名称)的原理。甲中装置Ⅱ (填“能”或“不能”)用乙装置来代替。
(2)甲中Ⅱ中盛有的液体是 。该装置可看作是一个 (填某仪器名称),简述其主要原理:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com