
2.卤素单质在物理性质上的差异性及递变规律
F2 Cl2 Br2 I2
状 态 气态 气态 液态 固态
淡黄绿色、黄绿色、红棕色、紫黑色
 颜 色
加深
颜 色
加深
(H2O)反应 溶解 溶解 微溶
 溶解度
逐渐减小
溶解度
逐渐减小
 熔沸点
升高
熔沸点
升高
Cl2、Br2、I2易溶于有机溶剂(苯、CCl4、CS2、汽油等),一般分别呈黄色、橙色、紫色,碘在酒精中呈黄褐色。液溴存放时用水封,碘易升华。
1.卤族元素包括F、Cl、Br、I、At五种元素,其原子最外层7个电子,在反应中易得到一个电子,显示强非金属性。随着电子层数的递增,原子半径逐渐增大,元素的非金属性逐渐减弱,而金属性逐渐增强。在自然界都以化合态存在。
9.(1)7Cl2+14NaOH=9NaCl+4NaClO+7H2O+NaClO3
(2)c(NaCl)=1.8mol·L-1;c(NaClO)=0.8 mol·L-1;
c(NaClO3)=0.2 mol·L-1。
讲析:本题应用“电子守恒法”解题。C12在70℃的NaOH水溶液中发生歧化反应,NaClO、NaCl03均为氧化产物,还原产物为NaCl。而NaClO与NaCl03的物质的量之比为4:l,就设它们的物质的量是4 mol和1 mol,则失去电子为9 mol,得到电子必然也为9 mol,即NaCl9为mol,氯气总物质的量为7 mol。化学方程式就好写了。参加反应的C12为49.7 g(物质的量为0.7 mol)生成的NaCl、NaClO、NaCl03物质的量分别为0.9 mol、0.4 mol、0.1 mol,再除以0.5L而求出各自的物质的量浓度。
8.(1)G<Y<Q<Z<X; (2)因电解Q的水溶液时,Q必在阳极失电子,化合价升高; (3)④Cl206+2OH-=ClO4-+
ClO3-+H2O;(4)C。
讲析:(1)由反应①知:G中Cl变NaCl化合价降低,则G变 Q ,Cl的化合价肯定升高,即C<Q,同理:由②得Q<X,由③知:C<Y<Q,由④知:Q<Z<X,综合起来即可得答案。(2)因电解时,②中H2O→H2化合价降低,则Q→X,Cl的化合价必然升高。 (3)因Cl206中Cl为+6价,发生歧化反应,Cl化合价升高,必变+7价,即最高价必为X,所以对应反应为④。(4)分析四个选项: A.HClO2氧化性增强与否,与反应速率无关,因这是自身分解反应。B.如是H+的催化作用,开始时反应速率就应迅速。C.随反应的进行,产生了Cl-对应有催化作用,符合题意。D.ClO2的逸出反应正向进行,生成物浓度升高。
6.(1)启普发生器,能;(2)饱和食盐水,储气瓶,关闭活塞时继续产生的氯气被迫进入Ⅱ,由于氯气在饱和食盐水中的溶解度较小,大部分氯气充满液面上空间内使液体压入漏斗中,保存在瓶Ⅱ中的氯气可以随时开启随时取用。
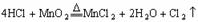 讲析:从题意看该项实验欲制取氯气并对过量的氯气随取随用,由此不难想出启普发生器的原理。从甲中Ⅱ图可以推测这不是一个洗气瓶(进气管太短)而是一个排液瓶,为什么要排液?题意上说多余的氯气随取随用,进而推知Ⅱ中所盛液体必然不能溶解氯气,常用饱和食盐水,即此装置相当于储气瓶。若留意观察不难看出,甲中Ⅱ与乙形异实同。
讲析:从题意看该项实验欲制取氯气并对过量的氯气随取随用,由此不难想出启普发生器的原理。从甲中Ⅱ图可以推测这不是一个洗气瓶(进气管太短)而是一个排液瓶,为什么要排液?题意上说多余的氯气随取随用,进而推知Ⅱ中所盛液体必然不能溶解氯气,常用饱和食盐水,即此装置相当于储气瓶。若留意观察不难看出,甲中Ⅱ与乙形异实同。
1. C;2.B、C;3.C;4.D;5.C、D;
讲析:1.只有NaClO符合3条要求。2.漂白粉是CaCl2和Ca(C10)2的混合物,但其有效成分为Ca(C10)2,A错;漂白粉在空气中发生以下反应而变质: Ca(C10)2+H20+CO2=CaCO3+2HClO;
2HclO=2HCl+02↑ ,B正确;Ca(C10)2为强碱弱酸盐,水解后显碱性,C正确,漂白粉使用时不能使用浓盐酸,因为要发生氧化还原反应:
Ca(C10)2+4HCl(浓)=CaCl2+Cl2↑+2H20, D错。
|
的反应:MnO2+4HCl MnCl2+Cl2↑+2H20可知MnO2过量,则0.6molHCl中最多有0.3mol被氧化,但实际上随着反应的进行,盐酸的浓度变稀,被氧化的HCl必然小于0.3mol,即溶液中Cl-的量必然大于0.3 mol,产生的AgCl的量大于0.3mol,当然小于0.6mol。 4.本题可采用“极值法”,显然H2、Cl2混合气体中Cl2的量越大,消耗的NaOH的量就越大,反之越小,Cl2的极限为aL,此时消耗NaOH物质的量为a/11.2,因Cl2的体积总是小于aL,故答案为D。 5.液氯为单质,氯水为混合物,二者既不是电解质又不是非电解质。不干燥的氯气遇二氧化硫发生反应:SO2+Cl2+2H2O==2HCl+H2SO4,二者漂白性能均减弱。A、B的结论均正确。
3.(1)甲:d,ae 乙:b、f, c 丙b,ce ;
(2)C(F)、B、E;(3)MnO2只能氧化浓HCl,随着反应进行,c(Cl-)减小,还原性减弱,反应不能继续进行。
讲析:本题综合性较强,既要熟悉Cl2的制法,又要抓住题给信息应用理论知识采取相应的实验措施。根据题给药品,制取Cl2应选用装置C或F,依据题给信息Cl2与Ca(OH)2的反应是放热反应,且温度高时易发生副反应,所以制漂白粉时应采取降温措施。Cl2有毒,又需进行尾气处理。
检测提高
1. C;2.C;
讲析:1.若含HCl为4mol的浓盐酸全部反应,生的
氯气为1mol,但是MnO2只有与浓盐酸才反应,随着反应的不断进行,盐酸越来越稀,反应将会停止。故生成的氯气小于1mol。 2.设金属的相对原子量为A,生成的氯化物的化学式为MClx,则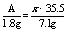 得A=9x可根据金属氯化物MClx中,x应为1,2,3…这样的正整数分别带人代数式中进行讨论:
得A=9x可根据金属氯化物MClx中,x应为1,2,3…这样的正整数分别带人代数式中进行讨论:
当x=1时,M为+1价金属,A=9与选项不符;
当x=2时,M为+2价金属,A=18与选项不符;
当x=3时,M为+3价金属,A=27,为A1元素。
10.100;(1)10,H2;(2)漂白,C12。
讲析:H2、Cl2的反应是左右两边气体体积相等的反应,无论怎样反应,体积都是100mL。H2过量不与水作用,体积为10 mL,而C12过量,有漂白性,但体积小于10 mL。
第20讲 (B卷)
纠错训练
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com