
1.B; 2.B、C。
讲析:1.溶液中存在Cl-、Br-、I‑三种离子,通入Cl2后先与I‑反应,原来三者物质的量之比是1:2:3,后来变成3:2:1,说明I‑没有完全反应,I‑少了两份,通的Cl2为一份,故Cl2与I‑物质的量之比是1: 3。 2.IBr分子中两非金属原子之间以共价键结合,它属于分子晶体,又因碘元素呈+1价IBr可以作为氧化剂,A、D选项说法正确。IBr与水反应生成HIO和HBr元素化合价无变化且无I‑。
10.96.6%。
讲析:由Ca(ClO)2的含量算出CaCl2的含量为42.83%,未反应的Ca(OH)2为2%。设该漂白粉为100g,Ca(ClO)2 、CaCl2共98g,则未反应的Ca(OH)2为2g。根据制取漂白粉的化学方程式可求出参加反应的
Ca(OH)2为57.1g,则可算出消石灰的利用率为96.6%。
第21课时 (B卷)
纠错训练
9.①碘化钾、生石灰;②Cl2+2KI=2KCl+I2,
Br2+2KI=2KBr+I2;CaO +H2O=Ca(OH)2。③混合物放在烧杯里,烧杯用一个盛有冷水的烧瓶盖上。加热时碘发生升华,蒸气遇冷凝结在烧杯底部外侧而与杂质分离。
讲析:先加2KI, Cl2、Br2转化为KCl、KBr。用吸水剂CaO吸水,再利用碘易升华的性质,通过升华法将碘与固体分离。
8.(1)3Br2+3CO32-=5Br-+BrO3-+3CO2↑;
(2)5Br-+BrO3-+6H+=3Br2+3H2O。
讲析:由题目提供的信息不难写出参加反应的物质,配平时要注意三大守恒的顺序。
7.+5;7。
讲析:由电荷守恒知n=1,则RO3-中R元素的化合价是+5价,因在生成物中有R-,可知R得一个电子即达到稳定结构,故其最外层电子数是7。
6.(1)D;(2)A、C;(3)I-+6OH--6e-= IO3-+3H2O,
|
6H++6e-=3H2↑,KI+3H2O KIO3+3H2↑
讲析:缺碘产生的病症是地方性甲状腺肿(大脖子病);KI中的碘离子具有强还原性且口感苦涩;电解KI溶液时阳极上是I-放电,阴极上是H+(水电离的)放电。
1.D;2.B、D;3.B;4.B;5.B;
讲析:1.从卤族元素的单质极其化合物的性质迁移可得出,砹单质的颜色比碘深、砹的氢化物不如碘化氢稳定、砹单质还不及碘与水的反应、砹的非金属性比碘弱。2.漂白粉的有效成分是氯酸钙,碘单质能使淀粉变蓝,A、C错误。3.单质的熔沸点逐渐升高,气态氢化物稳定性逐渐减弱,单质氧化性逐渐减弱,A、C、D错误。4.熟知有关卤素知识:①单质氧化性Cl2>Br2>I2,阴离子的还原性I->Br->Cl-;②碘单质能使淀粉变蓝,溴水为橙色。由此可推断出甲中加淀粉溶液和氯水,溶液变为橙色,说明甲中有Br-,再加丙溶液,颜色无明显变化,则说明丙中无I-。5.(1)采用极值法,若95mg全为氯化镁,则生成沉淀为287mg,小于300mg,当95mg全为杂质时,产生的沉淀的质量应大于300mg。则杂质写成MxCl2,xM的式量应小于镁的相对原子质量24,只有氯化铝行。
(2)采用平均值法,由MxCl2→2AgCl,得混合物的平均式量为90.9,氯化镁的式量为95,杂质的式量应小于95才符合题意。
4.每千克食盐中含KIO345mg,为合格食盐。
讲析:由题给的两个方程式可找出关系式:
KIO3→3I2→6 S2O32-,则每千克食盐中含KIO3的质量
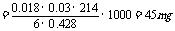
新活题网站
3.(1)2、4、4、2、1,Mn(或);
(2)①(CN)2+2KOH=KCN+KCNO+H2O,
②2SCN-+(CN)2=2CN-+(SCN)2。
讲析:(1)用化合价升降法配平。①(CN)2与KOH的反应相当于Cl2与KOH的反应;②由于阴离子的还原性Br-<CN-<SCN-,单质的氧化性Br2>(CN)2>(SCN)2,故(CN)2只能氧化SCN-而不能氧化Br-。
1. B;2.D。
讲析:1.从题给的反应出发,要证明食盐中存在
IO3-,必须有I-和6H+参加反应才生成I2,再用淀粉检验之。 2.碘酸根的化学式为IO3-,其中碘元素呈+5
价,另一碘原子呈+3价,碘酸碘应写成I(IO3)3,即I4O9。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com