
2. 二氧化硫
(1)物理性质:无色、刺激性气味、有毒气体,
密度比空气大,易溶于水(1∶40),易液化。
(2)化学性质:具有酸性氧化物的性质(与水、碱、碱性氧化物等反应)、较强的还原性(与O2、Cl2、Br2、I2等作用)、漂白性。SO2被O2氧化成SO3,SO3常温下是无色固体,熔沸点低,与水放出大量的热。
(3)SO2污染大气,形成酸雨,主要来源于化石燃料的燃烧、含硫矿石的冶炼和硫酸、磷肥、纸浆生产的工业废气。
典型题点击
1. 氧族元素
(1)氧族元素位于元素周期表中的第ⅥA族,包
括O、S、Se、Te、Po五种元素。
(2)相似性:它们的原子最外层有6个电子,最低价为-2价,最高价为+6价(O除外),还有中间价态+4价(O除外);气态氢化物通式为H2R,都有氧化物RO2、RO3(O除外),有含氧酸H2RO3、H2RO4。
(3)递变性:随着电子层数的递增,原子半径逐渐增大,元素的非金属性逐渐减弱,金属性逐渐增强,氧、硫表现出显著的非金属性,硒是半导体,碲能导电;单质熔沸点O2→Te逐渐升高,密度逐渐增大,氧化性逐渐减弱;氢化物稳定性减弱,还原性增强。
(4)硫俗称硫磺,淡黄色晶体,不溶于水,微溶于酒精,易溶于CS2。有较弱的还原性和氧化性(与Fe反应生成FeS)。
(5)臭氧(O3),特殊臭味的淡蓝色气体,密度、溶解度、活泼性、氧化性均大于氧气。具有不稳定性、极强的氧化性、漂白性。与O2互为同素异形体。
(6)过氧化氢(H2O2),是含有非极性键的极性分子。无色粘稠液体,呈弱酸性。具有不稳定性、强氧化性、漂白性和还原性。水溶液俗称双氧水,在实验室可用于制氧气。
15.HBr;2KMnO4+16HBr==2KBr+2MnBr2+5Br2+8H2O;
Br2+2OH-==Br-+BrO-+H2O。(1)75.8;(2)0.045mol/L
讲析:本题先是推断后是简单计算。酸化的KMnO4溶液与A的水溶液共热时,可获得一种棕红色气体产物B,B冷却至室温即凝为液体,可知B为Br2,从而得出A为HBr。
(1)原瓶中为HBr和空气的混合气体,平均式量为:
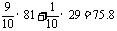
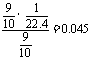
(2)溶液的物质的量浓度为: mol/L。
14.(1)ClO4F;(2)HClO4+F2=HF+ ClO4F;(3)吸收F2、HF,防止污染空气。(4)液氧;使产物固化而而与F2分离。(5)石墨催化使ClO4F全部分解。
讲析:(1)先求最简式再得到化学式;(2)在前一问知道X的基础上很易写出方程式;(3)从题给信息能找出答案;(4)用液氧比液氨好,液氧能使X凝结成固体,分离效果更好。(5)只有从X的完全分解这个角度来考虑,而石墨起催化作用,否则产率不为0。
11.(1)碳或(C)
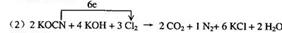
(3)35.5
讲析:(1)标出化合价,碳由+2→+4被氧化。
(2)根据化合价升降法配平。
(3)20L废水中含KCN 0.2mol,由电子守恒知需Cl2 0.5mol。
|
(2)XeF2+2KOH+KBrO3=KBr04+Xe↑+2KF+2H2O。(3)升高。
讲析:前两问用化合价升降法配平,第(3)问由信息进行分析可知:把HBrO3换成含KOH的KBrO3水溶液就得到了很纯的KBr04晶体,说明在碱性条件下易生成BrO4-。
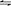
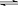 13.(1)氯气与水反应:Cl2+H2O HCl+HClO,HClO有强氧化性起杀菌、消毒作用;氯气还能将Fe2+氧化:Cl2+2Fe2+=2 Fe3+,Fe3+水解:Fe3++3H2O Fe(OH)3(胶体),Fe(OH)3胶体能吸附水中的悬浮杂质,使之净化。
13.(1)氯气与水反应:Cl2+H2O HCl+HClO,HClO有强氧化性起杀菌、消毒作用;氯气还能将Fe2+氧化:Cl2+2Fe2+=2 Fe3+,Fe3+水解:Fe3++3H2O Fe(OH)3(胶体),Fe(OH)3胶体能吸附水中的悬浮杂质,使之净化。
(2)向含有Cl2的自来水中加入少量液氨,发生反应:
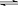 NH3+HClO
H20+NH2Cl,使不稳定的HClO转化为稳定的NH2Cl。随着消毒时HClO浓度的下降,平衡左移,HClO得以补充,从而延长液氯杀菌时间。
NH3+HClO
H20+NH2Cl,使不稳定的HClO转化为稳定的NH2Cl。随着消毒时HClO浓度的下降,平衡左移,HClO得以补充,从而延长液氯杀菌时间。
讲析:回答(1)从消毒、净化两方面入手,起作用的到底是什么?又为什么能生成这些物质?而(2)要从题给的平衡以及两物质的稳定性来考虑。
10.SO2;HBr;CO2、HCl。
讲析:该气体通入氯水中,得无色透明溶液说明无HBr;向溶液中加入盐酸酸化的BaCl2溶液,出现白色沉淀,说明有SO2。而CO2、HCl不能肯定。
8.C;9.B。
讲析:1.由氧化剂的氧化性大于氧化产物的氧化性
得出。 2.由于是置换反应,当X、Y都是金属时,X一定比Y活泼,当X是活泼金属(如Na)时,Y就是H2,所以A、C正确。B选项也应是X一定比Y活泼,D选项中当X是非金属时Y只能是非金属。3.金属元素(R)最高价氟化物的化学式为RFn,而其最高价的硫酸盐的化学式有两种R2(SO4)n(n为奇数)和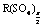 (n为偶数),设R是式量为X,列方程组解得。4.次氯酸钙与碳酸生成HClO(非氧化还原反应),它再在光照条件下分解(氧化还原反应)。5.氯化碘(ICl)与水反应,碘元素呈+1价与水中的OH-结合生成HIO,而氯呈-1价与水中的H+结合生成HCl。6.氟氯甲烷是产生氯原子的反应物,不是催化剂。7.A中ClO-、S2-,B中Fe3+、I-,D中H+、F-均不能大量共存。8.F2通入H2O中发生置换反应,生成HF20g,O28g。再算出HF的质量分数。9.A中HClO是弱酸不能拆开,C中用石灰乳应写成分子形式,D中Ag2CO3属于难溶物不能拆开。
(n为偶数),设R是式量为X,列方程组解得。4.次氯酸钙与碳酸生成HClO(非氧化还原反应),它再在光照条件下分解(氧化还原反应)。5.氯化碘(ICl)与水反应,碘元素呈+1价与水中的OH-结合生成HIO,而氯呈-1价与水中的H+结合生成HCl。6.氟氯甲烷是产生氯原子的反应物,不是催化剂。7.A中ClO-、S2-,B中Fe3+、I-,D中H+、F-均不能大量共存。8.F2通入H2O中发生置换反应,生成HF20g,O28g。再算出HF的质量分数。9.A中HClO是弱酸不能拆开,C中用石灰乳应写成分子形式,D中Ag2CO3属于难溶物不能拆开。
1. B;2.A、C;3.A、B;4.C;5.B;6.C;7.C
4.(1)BrCl3+2SO2+4H2O=2H2SO4+HBr+3HCl (2)n=3
讲析:(1)BrCl3是强氧化剂,必然是溴元素的化合价下降生成HBr,SO2作为还原剂生成H2SO4,确定了反应物和生成物,写出方程式配平即可。
(2)先找出关系式:
BrCln→HBr+nHCl→AgBr+nAgCl,然后再列比例式解题。
检测提高
3.(1)x=3
(2)3BrF3+5H2O=HBrO3+9HF+Br2+O2
(3)3BrF3;3BrF3和H2O
讲析:由题目提供的信息写出方程式再进行配平,满足质量守恒,求出x的值;再分析化合价的变化,找出氧化剂和还原剂。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com