
14.(1) g/L;(2)蓝,无;(3)偏高;(4)偏高。
讲析:(1)根据题给的三个方程式建立关系式:
O2→4S4O62-,再由关系式进行计算。(2)滴定至终点时无I2存在了,溶液由蓝色变为无色。(3)滴定管蒸馏水洗涤后,未用滴定剂Na2S2O3润洗,会导致它的浓度降低,多用了滴定剂Na2S2O3即V增大。(4)打开塞子加H2SO4时动作缓慢,空气中的氧气将参加反应,多消耗Na2S2O3即V增大。
13.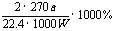 (1)I、G、H、F、E、J(或I、H、G、F、E、J),(2)无色固体;加BaCl2(aq)有白色沉淀产生,加稀硝酸不溶解。
(1)I、G、H、F、E、J(或I、H、G、F、E、J),(2)无色固体;加BaCl2(aq)有白色沉淀产生,加稀硝酸不溶解。
(3)
 讲析:(1)反应装置从左往右是:发生→收集→量气,装置的接口编号连接顺序不难排出;(2)考查了三氧化硫的物理性质和S042-的检验;(3)根据化学方程式进行计算。
讲析:(1)反应装置从左往右是:发生→收集→量气,装置的接口编号连接顺序不难排出;(2)考查了三氧化硫的物理性质和S042-的检验;(3)根据化学方程式进行计算。
12.(1)向红色消失后的溶液中滴加NaOH溶液,若再出现红色,说明为H202的酸性所致,甲同学的见解正确;若红色不再出现,则为酚酞被氧化所致,乙同学见解正确。(2)将褪色后的溶液加热,若红色再现,通入的是S02,若红色不再现,通入的是Cl2。
讲析:第1问只要证明有没有酚酞存在,而第2问应从二者的漂白原理不同入手。
11.取两份水解产物的水溶液,向一份中滴入品红溶液振荡褪色,证明有S02(或H2S03)生成;另一份中加入AgNO3(aq),振荡得白色沉淀,证明有HCl生成。
讲析:由题意只要证明S02和HCl存在即可。
4.SO2的漂白性与氧化性无关。5.H2S03酸性比H2C03强,SO2通到NaHCO3溶液中发生化学反应:SO2+2NaHC3=Na2SO3+2C02+H20,除去SO2。将气体干燥后再通过加热的铜网除02。6.由氧化还原反应规律知:H2SeO4的氧化性强于Cl2,亚硒酸的氧化性强于亚硫酸,A、C均错。而D中物质的量关系错误。7.此反应过氧化氢中被氧化成氧气。8.用“电子守恒法”解题。9.从反应现象可知:单质的氧化性Br2>I2>S,则还原性S2-> I-> Br-,元素的非金属性Br>I>S。10.与Na化合时,硫显-2价,氯显-1价这与元素原子的最外层电子数有关,与非金属性无关。
1. C 2.A 3.D 4.D 5.B 6.B 7.A 8.A 9.C、D;10.C。
讲析:1.活性炭使红墨水褪色,是因为它有吸附性,
此过程是物理变化。2.B中SO2既具有氧化性又具有还原性,SO2不是强氧化剂; C中SO2与Cl2的漂白原理不相同;D中H2SO3、HClO不稳定。3.①中2H2O2=2H20+02↑ pH升高;②中2H2SO3+O2=2H2S04 pH变小;
③中2Na2S+O2+2H20=4NaOH+3S pH升高;
④中Ca(OH)2+CO2=CaCO3↓+H20 pH变小;
⑤中Cl2+H20=HCl+HClO 、2HClO=2HCl+O2 pH变小;
⑥中2Na2SO3+O2=2Na2S04 pH变小。
3.⑴①2H2SO3+O2==2H2SO4;
②小,H2SO3+HClO==H2SO4+HCl
(或SO2+Cl2+2H2O==H2SO4 +2HCl);
⑵C; ⑶不可取,因SO2的排放总量没有减少,所以进一步形成的酸雨仍会造成对全球生物的危害。
讲析:⑴酸雨中含H2SO3,因其还原性较强,与O2反应生成H2SO4,pH变小。自来水一般用液氯消毒,与H2SO3反应,pH也变小;⑵减少酸雨产生的途径,就是要减少SO2的产生;⑶此项的答题关键是SO2的总量没有减少,从全球的范围来看,酸雨的危害并没有降低。
检测提高
1. D;2.D。
讲析:1.①、②、④的说法中所体现出不仅仅是SO2
的性质,CO2同样适合。③的说法中所体现出的性质Cl2也行。2.Fe与S反应生成FeS,1mol铁失去的电子数为2 NA ;三氧化硫标准状况下为固体;H2SO3为弱酸,1 L 0.01mol/L的H2SO3中,含H+个数远小于0.02 NA。
9.(1)A、E,F、D,C、B;浓硫酸;防止SO2被水溶解;(2)视线与量筒内液面最低点相平;上下移动量筒使其液面与广口瓶中液面相平。(3)50%;NaCl、Na2SO4。
讲析:(1)首先要认真分析实验原理,明确各仪器的作用。最左边是发生装置,中间两个组成量气装置,最右边是除杂装置。这样装置就好连接了。(2)气体的体积就是量筒内的水的体积,要精确读出水的体积才行。(3)滤液的焰色反应无紫色,则KNO3、K2CO3、K2SO4不存在,产生的气体全是SO2 ,物质的量为0.025mol,则Na2SO3的质量是3.15g,Na2S03的质量分数是50%。白色沉淀9.32 g是BaSO4,其物质的量是0.04mol,而加入的硫酸为0.03 mol,因而还有Na2SO40.01 mol,质量为1.42g,总质量还差1.73g就只能是NaCl了。
第22课时 (B卷)
纠错训练
8.(1)CS2+Na2S=Na2CS3;(2)P2S5+3K2S=2K3PS4;
(3)Na2S2+2HCl=S↓+H2S+2NaCl
讲析:氧和硫性质上具有相似性,将物质中的硫看
成氧,再根据相似反应判断。(1)由CO2与Na2O反应类
推;(2)由P2O5与K2O类推;(3)考虑Na2S2在酸性环境
的自身氧化还原反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com