
1.C 2.C 3.C 4.A 5.A 6.B、C 7.C 8.C 9.D 10.D 11.B 12.C 13.C 14.A 15.B 16.B、D 17.B 18.C
讲析:1.n(CO32-) + n(HCO3-) = 0.8mol
2 n(CO32-)+ n(HCO3-) = 1mol
n(CO32-)= 0.2 mol
n(HCO3-)= 0.8mol
4.(1)CO (2)HF
(3)2H2 + O2 = 2H2O
(4)2F2 + 2H2O = 4HF + O2
讲析:
检测提高
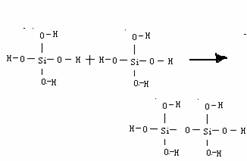
3.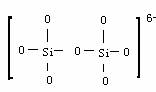
1. C 2. B、D。
16.
 (1) CaCO3 CaO+ CO2↑
(1) CaCO3 CaO+ CO2↑
 CaO + SiO2 CaSiO3
CaO + SiO2 CaSiO3
(2) 4.48L
(3) 6g
讲析: CaCO3高温分解生成CaO、CO2,CaO和SiO2反应生成CaSiO3。固体减少的质量是CO2。所以m(CO2)= 26g-17.2g = 8.8g n(CO2)=0.2mol
V(CO2) = 4.48L
n(CaCO3)= n(CO2)= 0.2mol
m(CaCO3)= 20g
m(SiO2) = 26g – 20g = 6g
第25课时 (B卷)
纠错训练
15. Si、Na2SiO3、H4SiO4、H2SiO3、SiO2。
14. 纯碱、石灰石、石英。水泥回转窑。
纯碱、石灰石、石英。水泥回转窑。
Na2CO3 + SiO2 Na2SiO3 + CO2↑

CaCO3 + SiO2 CaSiO3 + CO2↑
Na2O·CaO·6SiO2
13.粘土,石灰石。硅酸三钙、铝酸三钙、硅酸二钙。3CaO·SiO2、3CaO·Al2O3、2CaO·SiO2。水硬性。
1.B 2.C 3.C. 4.A、C 5.D 6.C 7.C 8.A 9.B.10.A 11.A.12.A、D
讲析:1.等质量的Si和O2反应时Si过量,过量的Si也是固体,所以固体中氧的质量分数为50%。 4.反应1、2是氧化还原反应,不是可逆反应,根据能量守恒原理,正向反应是放热反应,逆向反应为吸热反应。 8. CO2是由分子构成的,是分子晶体。SiO2是由原子构成的,是原子晶体。物理性质不同,化学性质几乎相同。 9. SiO2不与盐酸反应,CaO、CaCO3与盐酸反应生成可溶性的物质。 10.活性炭有吸附性,能吸附有色物质使溶液褪色,没有发生化学反应。过氧化钠、漂白粉将有色物质氧化成无色物质具有漂白性。二氧化硫与有色物质(一般是品红)结合成不稳定的无色物质。 12.该题为试剂的保存题,见光易分解的物质应避光保存,在空气中易氧化的物质应隔绝空气保存。碱性溶液不用玻璃塞。
4. (1)Mg + SiO2 MgO + Mg2Si 放热反应
(1)Mg + SiO2 MgO + Mg2Si 放热反应
(2)SiH4
讲析:1.CCl4分子中碳原子与氯原子是极性共价键,CCl4分子是非极性分子。SiCl4和CCl4分子结构相似,根据结构相似性质相似的原理,SiCl4和CCl4性质相似。①、②、③都正确。 2. A、B、C的反应均是歧化反应,氧化剂、还原剂是同种物质,所以质量比和物质的量比相等。
新活题网站
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com