
9.配平下列化学反应方程式(或离子方程式)
⑴(NH4)2PtCl6-Pt+NH4Cl+N2+HCl
⑵高锰酸钾和氢溴酸溶液可以发生下列反应: KMnO4+HBr®Br2+MnBr2+KBr+H2O 其中还原剂是 。若消耗0.1摩尔氧化剂,则被氧化的还原剂的物质的量是 摩尔。
⑶在热的酸性溶液中,0.1molKNO3正好氧化
300mL1mol/LFeCl2,KNO3被还原为氮的氧化物。
KNO3+ FeCl2+ HCl - KCl+ FeCl3+ + H2O
(此题考查氧化还原反应知识的应用能力)
8.为了检验某白色粉末物质的成分, 进行如下实验
(1)取适量未知物的粉末少许, 加水充分搅拌, 使其溶解, 得到溶液A。
(2)取A溶液少量, 加入稀硝酸酸化, 生成无色、无气味的气体, 该气体可使澄清石灰水变浑浊。反应后溶液中加入AgNO3溶液时, 没有沉淀生成。
(3)取A溶液少量, 加NaOH后共热, 生成有刺激性气味的气体, 该气体可使湿的红石蕊试纸变蓝。
(4)取未知物粉末少量, 加热至120℃, 生成等体积的三种气体, 最后白色粉末完全消失。
根据上述各实验现象, 推断该未知物可以是 。
(此题考查铵盐知识的综合应用能力。)
7.氨分子的电子式为 , 结构式为 。氨气极易溶于水, 其水溶液显 性, 氨在水中反应的化学方程式为 , .主要离子有 。玻璃棒蘸浓盐酸接触氨气时, 观察到的现象为 , 生成物是 , 它的结构中化学键有 、 . 该物质属于 晶体。
(此题考查氨气的结构、性质等知识。要求能熟记。)
6. 为了更简便制取干燥NH3, 下列方法适当的是 ( )
A.NH4Cl + 浓H2SO4, 生成气体用碱石水干燥
B. , 用烧碱干燥
, 用烧碱干燥
C.加热浓氨水, 气体用碱石灰干燥
D.加热NH4HCO3, 气体用P2O5干燥
(此题考查氨气的实验室制法的知识。)
5.25°C时,在体积固定的密闭容器中, 适量NH3(气)和Cl2(气)恰好完全反应, 若反应产物只有N2和NH4Cl, 则反应前后容器中压强比接近于 ( )
A.1∶1 B.11∶1
C.7∶11 D.11∶7
(此题考查接受信息的能力及阿伏加德罗定律的运用。)
4.在标准状况下, ①HCl ②NH3 ③SO2 ④NO2分别充满容积相同的烧瓶做喷泉实验, 都获成功, 则生成溶液物质的量浓度相同的是 ( )
A.①②③ B.①②③④ C.①②④ D.①②
(此题考查气体溶于水的物质的量浓度计算。)
3.将下列固体于隔绝空气的密闭容器中加热,在加热过程中发生了化学反应,但冷却后又聚集为原来物质的是( )
A、NH4Cl B、NH4I
C、碘片 D、红磷
(此题考查氯化铵等物质的性质。)
2.在酸性溶液中能大量共存,并且溶液为无色透明的离子组是 ( )
A.NH4+、Al3+、SO42-、NO3-
B.K+、Na+、CO32-、NO3-
C.K+、NH4+、MnO4-、SO42-
D.Na+、K+、NO3-、HSO3-
(此题考查NH4+、Al3+、HSO3-等离子的性质,这些离子是高考常考的几种离子,应该熟练掌握。)
1.反应4NH3(气)+5O2(气) 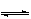 4NO(气)+6H2O(气)在2升的密闭容器中进行,1 分钟后,NH3减少了0.12摩尔,则平均每秒钟浓度变化正确的是( )
4NO(气)+6H2O(气)在2升的密闭容器中进行,1 分钟后,NH3减少了0.12摩尔,则平均每秒钟浓度变化正确的是( )
A.NO:0.001摩/升 B.H2O:0.002摩/升 C.NH3:0.002摩/升 D.O2:0.00125摩/升
(此题考查化学反应速率的表示方法及有关计算。)
5.(96年上海高考题).实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:
试回答:(1)如果选用测定反应物CuO和生成物H2O的质量(mCuo、mH2O)时,请用下列仪器设计一个简单试验方案.
①仪器连接的顺序(用字母编号表示,仪器可重复使用) ;
d中浓硫酸的作用是 , ;
实验完毕时观察到a中的现象是 ;
②列出计算Cu的相对原子质量的表达式 。
③下列情况将使测定结果偏大的是 .(以下选择填空不限1个正确答案,均用字母编号填写)
(a)CuO未全部还原为Cu (b)CuO受潮
(c)CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有


(此题考查实验的设计能力,实验的分析能力及实验综合运用能力。)
新活题网站
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com