
8. NH4HCO3 讲析:由(1)可知固体是可溶性化合物。由(2)可知固体中含HCO3-或CO32-离子,无Cl-离子。由(3)可知含有NH4+离子。由(4)及前面信息可推固体是NH4HCO3。
7.略
1.AC 2.A 3.A 4.B 5.B 6.C
讲析:2.在酸性条件下,弱酸根离子、氢氧根离子、酸式弱酸根离子不能大量存在,MnO4-离子为紫红色。3.NH4Cl分解生成HCl和NH3,HCl和NH3冷却后又生成NH4Cl。NH4I分解生成NH3和HI,HI不稳定,继续分解生成H2和I2。4.HCl、NH3、SO2完全溶解于水,标准状况下,所得溶液的物质的量浓度为1/22.4mol/L。设NO2体积为1L(标况),则物质的量为1/22.4mol,NO2与水反应生成HNO3和NO,生成HNO3 0.298mol,溶液的体积为2/3L。其浓度为.0446mol/L。 5.氨气和氯气反应生成氯化铵和氮气,其方程式:
8NH3 + 3Cl2 = 6NH4Cl(固体) + N2 根据同温同压下,压强比等于物质的量比。
5.(1)①b,c,a,c,d。
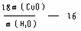 吸收未反应的氨气,防止空气中是水分进入。固体由黑色变为红色。②
③a、c
吸收未反应的氨气,防止空气中是水分进入。固体由黑色变为红色。②
③a、c
(2) a、c
新活题网站
1.A 2.B 3.A 4.C
讲析:1.实验室里用氯化铵固体和熟石灰在加热条件下反应制氨气,也可以用浓氨水加热制氨气。 2.铵盐都溶与水,属于离子化合物,是离子晶体。与碱反应生成氨气。加热分解,不一定产生氨气。 3.铵盐的检验方法是取样品加碱(常用NaOH溶液)加热,产生的气体使红色石蕊试纸变蓝色(氨气的水溶液呈碱性。),可以用酚酞试纸检验。 4.设氨水、水各1升。氨气质量为227.5g,氨水质量:1910g。NH3%=227.5/1910=11.9% 若等质量取氨水和水混,所得溶液浓度为12.5%。等体积取氨水和水混和,水的质量偏多,浓度小于12.5%。
16.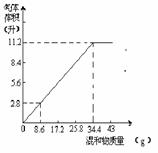 在100ml NaOH溶液中加入NH4HCO3和(NH4)2SO4的固体混合物,加热充分反应。右图表示加入的混合物质量和产生的气体体积(标准状况)的关系,试计算:
在100ml NaOH溶液中加入NH4HCO3和(NH4)2SO4的固体混合物,加热充分反应。右图表示加入的混合物质量和产生的气体体积(标准状况)的关系,试计算:
(1)NaOH溶液的物质的量浓度
(2)当NaOH溶液的体积为140mL,固体混合物质量是51.6g时,充分反应后,生成气体的体积为多少升?
(3)当NaOH溶液体积为180mL时,固体混和物的质量为51.6g时,充分反应后,生成气体的体积为多少升?
15.标准状况下的NO2、NH3、H2组成的混合气体11.2L, 通过一定量的稀HNO3溶液, 溶液的质量增加了12.5g, 混合气体体积缩小为4.48L, 求混合气体中各成分分别为多少?
14.(2002年综合试题 )制取氨气并完成喷泉实验(图中夹持装置已略去)。
⑴. 写出实验室制取氨气的化学方程式:
. ⑵. 收集氨气用 法,要得到干燥的氨气可选用
作干燥剂。
 ⑶.用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是
⑶.用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是
该实验的原理是 .
⑷. 如果只提供如图2的装置,请说明引发喷泉的方法。
.
13.人类也可主动地参与氮循环,合成氨工业就是参与上图过程 ①的手段之一,氮肥的生产和使用促进了植物体内蛋白质和核酸的合成,使农业生产取得了飞速发展,以天然气为原料合成氨是新的生产氮肥的方法,它具有污染小、成本低等诸多优点。 其过程大体如下:
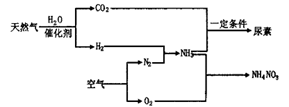
(1)请写出用天然气制备氢气的化学方程式:
(2)写出合成尿素反应的化学方程式:
(3)某工厂以标准状态下的含CH489.6%的天然气100 m3为原料经过上述过程,只生产NH4NO3,不生产尿素, 若生产中氮元素无损失,求最多可制得NH4NO3化肥的质量。
12.(96年上海高考试题).(A)化合物E(含两种元素)与NH3反应,生成化合物G和H2.化合物G的相对分子质量约为81,G分子中硼元素(B相对原子质量为10.8)和氢元素的质量百分含量分别是40%和7.4%由此推断:
(1)化合物G的分子式为 ;
(2)反应消耗1摩NH3,可生成2摩H2,组成化合物E的元素是 和 ;
(3)1摩E和2摩NH3恰好完全反应,化合物E的分子式为 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com