
4.(1)稀,a、c。 (2)a、c
(3)b ,Cu(OH)2 、 Fe(OH)3 。
新活题网站
3.n(Cu)= 0.0006mol,n(NO+NO2)=0.001mol
所以n(HNO3)=0.0006*2mol + 0.001mol=0.0022mol
2.设参加反应的金属2mol,被还原的硝酸1mol
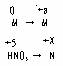 根据电子守恒原理;2a = 5- X
根据电子守恒原理;2a = 5- X
讨论;a=1时,X=3
a=2时,X=1
a=3时,X=-1
1.AC 2.C 3.C
讲析:1.(1)Cu + 4HNO3(浓)=Cu(NO3)2 + 2NO2↑ +2H2O
(2)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
 (3) 2Cu + O2 2CuO,
(3) 2Cu + O2 2CuO,
CuO + 2HNO3 = Cu(NO3)2+H2O
制得1mol Cu(NO3)2需4mol浓HNO3,需8/3mol稀HNO3,Cu先氧化成CuO,再变成Cu(NO3)2,需2molHNO3
13.在100ml混合酸的溶液中,硝酸的物质的量浓度为0.5mol/L,硫酸的物质的量浓度为0.15mol/L,向其中加入5.76g铜粉,微热,使其充分反应。
(1)求溶液中Cu2+的物质的量浓度.
(2)若要使5.76g铜粉完全溶解,且溶液中只存在一种盐,则原溶液中的硝酸和硫酸的物质的量浓度分别是多少?
14(1998年上海高考题).65%HNO3(质量为M1)中加72%Mg(NO3)2溶液(质量为M2)后蒸馏。分别得到97.5%HNO3和60%Mg(NO3)2溶液(不含HNO3)。
(1)若蒸馏过程中HNO3、Mg(NO3)2、H2O均无损耗,求蒸馏前的投料比M1/M2的值。
(2)蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(M1+M2)×5.0%的H2O流失。则投料时,比值M1/M2应该 (选填增大、减小或不变)。
(计算过程)
12.1.92g铜和一定量的浓硝酸反应,随着铜的不断减少,反应生成的气体颜色也逐渐变浅。当铜反应完毕时,共收集到气体体积为1.12L(标况)。求反应中消耗的HNO3的物质的量。
11.在稀HNO3和稀H2SO4的混合溶液200mL中,滴入10mL 1mol/L的NaOH溶液恰好中和。向同量的这种混合溶液中加入过量BaCl2溶液,所生成的BaSO4沉淀,经洗涤干燥后,生成0.5825g,试求该混合溶液中HNO3和H2SO4的物质的量浓度。
10.硝酸工业尾气中的氮的氧化物(NO、NO2)是要大气污染物,其常用的治理方法有以下两种(已简化):
①NaOH吸收法。反应原理是:
2NO2+2NaOH NaNO3+NaNO2+H2O
NO+NO2+2NaOH 2NaNO2+H2O
②氨催化还原法。反应原理是NOx+NH3 N2+H2O 现有一定量的含NO2和NO的硝酸工业尾气(不含其他气体)若用过量NaOH溶液吸收后,溶液中NaNO3与NaNO2的物质的量之比恰好与尾气中NO和NO2的物质的量之比相等。
N2+H2O 现有一定量的含NO2和NO的硝酸工业尾气(不含其他气体)若用过量NaOH溶液吸收后,溶液中NaNO3与NaNO2的物质的量之比恰好与尾气中NO和NO2的物质的量之比相等。
(1)若用NOx表示氮的氧化物的平均组成,试求x的值。
(2)将1体积该尾气用氨催化还原法处理,至少消耗多少体积相同状况下的氨气?
9. L、M、R、P、Q分别代表五种含不同化合价的氮元素的物质。A、B分别代表两别含不同化合价的氯元素的物质(每种物质中,氮或氯元素的化合价只有一种),又知物质M中的氮元素的化合价要比物质Q中氮元素的化合价低。在一定条件下,它们会发生如下的转化(关系式未配平):
①P+A→Q+B ②L+O2→M+H2O
③L+M→R+H2O ④B+H2O→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是 ,理由是 。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途。据此推断在同温、同压下,若物质R的密度比二氧化碳的密度小,则R的化学式为 .
(3)某学生写出下面三个含氮的物质的相互转化的关系式:
(a)M+P→N2O3+H2O
(b)N2O4+H2O→P+Q
(c)M+L→Q+H2O
其中一定不可能实现的是 ,理由是 。
8.0.96g Mg跟含6.3g HNO3的稀溶液恰好反应完全,则HNO3的还原产物的相对分子质量可能是 ( )
A.30 B.44 C.46 D.80
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com