
9.在适当的温度和压强下,4体积某气体化合物完全分解后产生1体积磷蒸气和6体积氢气,由此可以推断该气态化合物分子式是 ,该分解反应的化学方程为 。
8.已知下列物质的标准生成热:Fe3O4(s)为1117.13KJ/mol,CO (g) 为110.54 KJ/mol,CO2(g)为393.51 KJ/mol,则反应:Fe3O4(s)+4 CO (g)=3 Fe(s)+4 CO2(g) ;
A. ΔH= ( )
A.-14.75 KJ/mol B. +14.75 KJ/mol
C.-110.54 KJ/mol D.-29.5 KJ/mol
7.物质的生成热可定义为由稳定单质生成1mol物质所放出的热量,如二氧化碳气体的生成热就是C(s)+O2(g)=CO2(g)的反应热已知下列几种物质的生成热:葡萄糖-1259 KJ/mol,H2O-285.8 KJ/mol,CO2-393.5 KJ/mol。则1Kg葡萄糖在人体内完全氧化成二氧化碳气体和液态水,最多可提供的能量为 ( )
A.3225 KJ B.2816 KJ
C.6999 KJ D.15645 KJ
6.已知H-H键能为436 KJ/mol,H-N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3 ΔH=-92.4 KJ/mol,则N≡N键的键能是 ( )
A.431 KJ/mol B.946 KJ/mol
C.649 KJ/mol D.869 KJ/mol
5.已知下列两个热化学方程式:
C(s)+O2(g)=CO2(g);ΔH=-393.5kJ/mol
2H2(g)+O2(g)=2H2O(g);ΔH=-483.6kJ/mol
现有0.2mol炭粉和氢气组成的悬浮气体,在氧气中完全燃烧,共放出63.53kJ的热量。则炭与氢气的物质的量之比是 ( )
A.1:1 B.1:2 C.2:3 D.3:2
4.一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量饱和石灰水完全吸收,可得100gCaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量( )
A.0.5Q B.Q C.2Q D.5Q
3.航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化引发高氯酸铵反应,其方程式可表示为: NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑;△H<0
下列对此反应的叙述中错误的是( )
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只能起氧化剂作用
2.为减少汽车对城市大气的污染,近年来中国成功地开发了以新燃料作能源的“绿色汽车”。 这种汽车可避免有毒的有机铅、苯和苯的同系物以及多环芳烃的排放,保护环境。这种“绿色汽车”的燃料是( )
A.甲醇 B.汽油 C.柴油 D.重油
1.我国内蒙古的白云鄂博拥有世界上最大的稀土元素矿床。提炼时使稀土元素(以R代表)与铁、锰等分离的方法之一是在已处理后的矿石的硫酸浸出液中加入Na2SO4粉末,使稀土的硫酸盐转化为沉淀:R2(SO4)3+ Na2SO4+ xH2O
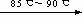 R2(SO4)3· Na2SO4·
xH2O
R2(SO4)3· Na2SO4·
xH2O
下列判断中正确的是( )
A.反应要在碱性溶液中进行
B.该反应原理属于化合反应
C.生成的沉淀物属于酸式盐
D.反应表明Na2SO4的溶解度更小
5.今有如下三个热化学方程式:
H2(g)+1/2O2(g)=H2O(g);△H =a KJ/mol
H2(g)+1/2O2(g)=H2O(l);△H =b KJ/mol
2H2(g)+ O2(g)=2H2O(l);△H =c KJ/mol
关于它们的下列表述,正确的是( )
A.它们都是吸热反应 B.a、b和c均为正值
C.反应热的关系:a=b D.反应热的关系:2b=c
检测提高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com