
2. 碱金属元素的原子结构
(1)相同点:碱金属最外电子层上都只有一个电子,容易失去。
(2)递变规律:随着核电荷数增大,电子层数增多,原子半径逐渐增大。
1.金属元素包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)。钫(Fr)是放射性元素,中学里通常不讨论。碱金属是一类化学性质非常活泼的金属,在自然界中都以化合态存在。
17.化肥厂有一个制取水煤气的生产工艺:
C(s)+H2O(l)= CO (g)+H2 (g);ΔH=+131kJ/mol
C(s)+ O2(g)= CO2(g);ΔH=-393kJ/mol
假定要得到2000Kg水煤气,理论上要多少千克空气才能使炉温回到原来的温度?
16.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是两种原子间形成1mol化学键时释放的能量或断开1mol化学键时所吸收的能量。现提供以下化学键的键能(kJ/mol)P-P:198 P-O:360 O=O:498 P=O:585
试根据这些数据,计算以下反应的Q
P4(白磷)(g) + 5O2(g) = P4O10(g); ΔH=-Q kJ/mol
(提示:白磷是正四面体型的分子,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外每个磷原子又以双键结合一个氧原子)
15.已知X为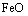 和
和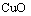 的混合物,取两份等质量的X样品进行下列实验:
的混合物,取两份等质量的X样品进行下列实验:
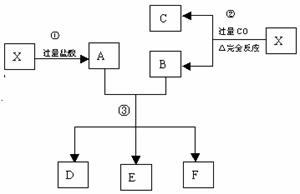
固体 酸性溶液 无色气体
(1)写出①、②和③步所有反应的化学方程式;
(2)设从③步所得固体D的质量为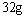 ,溶液E中只含有一种金属离子,气体F在标准状况下体积为
,溶液E中只含有一种金属离子,气体F在标准状况下体积为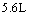 ,试计算取用的每份X的质量和X中
,试计算取用的每份X的质量和X中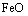 和
和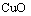 的质量比。
的质量比。
14.1mol气态钠离子和1mol气态氯离子结合生成1mol 氯化钠晶体所释放出的热能为氯化钠晶体的晶格能。
(1)下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是 。
A.Na+(g) + Cl-(g) = NaCl(s) ΔH
B.Na(s) +1/2Cl2(g)=NaCl(s) ΔH1
C.Na(s)= Na(g) ΔH2 D. Na(g) -e-= Na+(g) ΔH3
B. E.1/2Cl2(g) =Cl(g) ΔH4
F.Cl(g)+ e-= Cl-(g) ΔH5
(2)写出ΔH1与ΔH、ΔH2、ΔH3、ΔH4、ΔH5之间的关系式 。
已知氧化亚铁晶体结构跟氯化钠晶体结构相似,则:
(3)氧化亚铁晶体中,跟二价铁离子紧邻且等距的氧离子的个数是 。
(4)设阿伏加德罗常数值为NA,若氧化亚铁的密度为ρg/cm3,则氧化亚铁晶体中二价铁离子与氧离子之间最近距离是 cm(用代数式表示)。
(5)若氧化亚铁晶体中有3n个二价铁离子被2n个三价铁离子所替代,该晶体中氧离子的数目将 (填“减少”、“增多”或“保持不变”)。
13.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
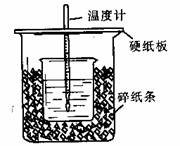
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”、“无影响”)。
(4)实验中60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”),简述理由
。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”、“偏小”、“无影响”);用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”、“偏小”、“无影响”)。
12.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 KJ。(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
11.已知X和Y是短周期元素中的同族单质, W、V是化合物,它们有如下反应(式中系数及反应条件均略去):X + W =Y + V,试写出符合上述题意并满足下列要求的化学方程式:
① W是水 ;
② W、V均是氧化物 。
10.把试管放入盛有25℃时饱和石灰水的烧杯中,试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
(1)实验中观察到的现象是 ;
(2)产生上述现象的原因是 ;
(3)写出有关反应的离子方程式 ;
(4)由实验推知,氯化镁溶液和氢气的总能量 (填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com