
12.设烯烃的体积为x、炔烃的体积为y。
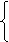
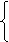 则有 : x+y=aL
x=2a-b
则有 : x+y=aL
x=2a-b
2x+y=bL y=b-a
即可以很轻松的得答案C。
11. 根据烃的燃烧化学方程式:CxHy+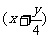 O2
O2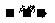 xCO2+
xCO2+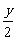 H2O
ΔV少
H2O
ΔV少
1mol (1+y/4)×22.4
xmol 44.8xL

 得y=4。
得y=4。
9.C5H10的同分异构体中能氧化成醛的是:CH2=CHCH2CH2CH3、CH2=CHCH(CH3)2 、CH3CH=CHCH2CH3所以产生醛的种类为5种。注意若烯烃和双键相连的碳原子上若没有H原子,则该烯烃被氧化为酮,而不是醛。
1.A 2.AC 3.C 4.D 5.C 6.B 7.C 8.AC 9.A 10.BD 11.BD 12.C
讲析:1.通过甲烷和乙烯的性质可知答案C、D肯定不可以,而B答案若用液溴则甲烷溶于其中,故也不可以。2.由于乙烯和一氧化碳有相同的相对原子质量,若质量相同,且在相同的条件下有相同的物质的量和相同的体积和密度。3.制取乙烯的原料是用乙醇和浓硫酸,而非3mol/L的硫酸。而且要求温度计在液面下,控制温度在170℃。实验结束时先取出导管后熄灭酒精灯。4.参于加成的H2为100mL,所以炔烃的体积为50mL。故烷烃和炔烃的体积比为150∶50=3∶1。5.根据烃和HCl的体积比可知该烃中含两个双键或一个叁键,再根据加成后产物与Cl2取代的体积比可知加成后产物中含6个氢,及原来产物中含4个氢。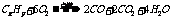 7.可通过化学方程式:
7.可通过化学方程式: 不难看出x=4、y=8。
不难看出x=4、y=8。
3. (1) 1:1:4 1:2:5 1:3:6
(2)n3=3n1 + n2
讲析:设混气平均分子式为CxHy,则:
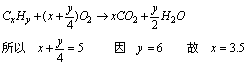 即平均碳原子数为3.5,设C2H6、C3H6、C4H6的比为a:b:c则
即平均碳原子数为3.5,设C2H6、C3H6、C4H6的比为a:b:c则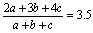 故c=3a+b,因a、b、c均为小于8、大于0的正整数
所以a=1,b=1时c=4,a=1,b=2时c=5,a=1 b=3 c=6
故c=3a+b,因a、b、c均为小于8、大于0的正整数
所以a=1,b=1时c=4,a=1,b=2时c=5,a=1 b=3 c=6
新活题网站
2.⑴C10H10
⑵A:(CH3)3CCH=CHC(CH3)3 G:(CH3)3CCOOH
⑶4种
讲析:⑴碳的质量分数为0.857,则该烃通式为(CH2)n,又相对分子质量为140,则化学式为C10H10
⑵根据题意,结构中有2个碳原子不与氢直接相连,如果这两个是C=C,则经过氧化后不会得到羧酸,只能得到酮,假设不成立。所以这种碳原子只能在烃基中。又因A在一定条件下氧化只生成G,则A一定具有对称结构。
⑶与G同类物质的同分异构体中一定有-COOH,其余为丁基,而已知丁基有4种同分异构体。
1. ①7、单烯烃结构以C=C为中心对称;
②CH3CH2CH=CHCH2CH3、 (CH3)2CH-CH=CH-CH(CH3)2
讲析:其7种结构碳架分别是:

17. 常温下由烷烃A和单烯烃B组成的混合气体,已知(a)将1L混合气体充分燃烧,在同条件下得到2.5L CO2气体;(b)B分子中碳原子数比A分子多,且最多为4个.
(1)求A、B所有可能的组合及体积比
(有几种写几种,可以不写满、也可以增加)
|
|
可能的组合 |
VA∶VB |
|
|
|
A |
B |
|
|
① |
|
|
|
|
② |
|
|
|
|
③ |
|
|
|
|
④ |
|
|
|
(2)1200C时取1L该混合气与9LO2混和充分燃烧,当恢复到1200C和燃烧前的压强时,体积增大6.25%,试通过计算确定A和B的分子式.
16.某同学设计如图所示实验装置粗略测定电石中碳化钙的质量分数。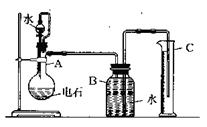
(1)烧瓶中发生反应的化学方程式是
,装置B和C的作用是 。
烧瓶要干燥,放入电石后应塞紧橡皮塞,这是因为
。
(2)所用电石质量不能太大,否则 ,
若容器B的容积为250mL(标准状况)则所用电石质量为
g.
(3)漏斗与烧瓶之间的玻璃导管连接,其目的是
。
(4)实验中测得排入量筒中水的体积为VmL(换算成标准状况),电石的质量为Wg,则电石中碳化钙的质量分数
(不计导管中残留水)。
15.潮湿的酸式盐A与化合物B在研钵里混合研磨时,产生C、D两种气体和固体E。C遇浓盐酸冒白烟。D在空气中燃烧时产生浓烟,且有一种生成物与E在高温下分解的气体产物F相同。C与F混合后通入氧化钙溶液中会生成白色沉淀E。请写出下列空白:
(1)写出A、B的化学式:A ;B
(2)潮湿的A和B混合研磨时有关反应的化学方程式是:
、
;
(3)C与F的混合气体通入CaCl2溶液中生成沉淀E的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com