
2.C 讲析:由铜元素守恒,可知C正确。H2还原CuO的实验操作要求是:先通入H2排空气,加热反应后得到的Cu要在H2流中冷却,所需H2比反应消耗的H2要多,则A、B、D不正确。
1.(1)①③⑤;②④⑦⑧ (2)①③⑥,A
(3)①②③④⑥⑧,B (4)⑥
讲析:气体的收集方法有:①向上排空气法(收集密度比空气大的气体);②向下排空气法(收集密度比空气小的气体);③排水集气法(收集难溶于水的气体)。
利用两导气管的长短可判断采用何种收集方法。
7.(2)g接a,b接c,d接e,f接h。或g接c,d接a,b接e,f接h。
(3)上;用燃着的木条放在瓶口,若火焰熄灭,则证明CO2已经充满。
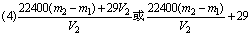 (5)偏低:因为含有H2S、HCl、H2O等杂质气体的式量均小于CO2的式量。
(5)偏低:因为含有H2S、HCl、H2O等杂质气体的式量均小于CO2的式量。
第46课时 (B卷)
纠错训练
6. (1)出现浑浊
(1)出现浑浊
 ONa+CO2+H2O→
OH+NaHCO3
ONa+CO2+H2O→
OH+NaHCO3
(2)紫红色褪去 CaC2+2H2O→Ca(OH)2+C2H2↑
(3)出现浑浊,最后消失
Ag++NH3·H2O→AgOH+NH4+
AgOH+2NH3·H2O=Ag(NH3)2++OH-+2H2O
(4)防止液体倒吸
1.C 2.B 3.D 4.C 5.C
讲析:1.实验室制备气体要操作简单,容易分离,经济实惠,切实可行。甲烷在高温下才能分解成H2和C,实验室难以办到。赤热的炭与水蒸气反应生成CO和H2,难以分离。4.加热固体,试管口应略向下倾斜(A、B错),NH3、NO2溶于水或与水反应(B、D错)。
3.(1)关闭弹簧夹时,反应产生的气体使试管内液面上的压力增加,所以液面下降。
(2)塞紧橡皮寨,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,漏斗中与试管中的液面差保持不再变化,说明装置不漏气。 (3)
|
CO2 |
向上排空气法 |
通入澄清石灰水使石灰水变浑浊 |
(4)因为:此反应需要加热 MnO2是粉末状的
新活题网站
2.(1) ③ 、 ⑦ 、 ⑤ 、 ② 、 ;
MnO2 NaCl Al,NaOH
 和浓HCl 、和H2O 、浓硫酸 、 和H2O 、 ;
和浓HCl 、和H2O 、浓硫酸 、 和H2O 、 ;
(2)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
 Cl2+2NaOH=NaCl+NaClO+ H2O
Cl2+2NaOH=NaCl+NaClO+ H2O
2Al+3Cl2 2AlCl3
讲析:实验室制取氯气应选用MnO2和11.9mol·L-1盐酸 (浓盐酸)共热,而不应选2mol·L-1盐酸(稀盐酸);所制氯气中含(HCl和H2O)必须先通过食盐水(除HCl),再通过浓硫酸(除H2O),得到的纯净氯气通入②中发生反应,并注意吸收多余的尾气。装置接口要匹配,洗气时应“长进短出”。
1.(1)NO
(2)①C2H4 装置中没有温度计,无法控制反应温度
②Cl2 反应生成的Cl2被C中的NaOH溶液吸收了
③NH3 反应生成的NH3被C中的H2O吸收了
讲析:由所给装置图和题意可知:①发生装置适用于固+液(或液+液)反应(可加热或不加热);②对不同气体,洗气、干燥所用试剂应有所不同。A选项中制C2H4,装置中没有温度计,无法控制反应温度;B选项中反应生成的Cl2被装置C中的NaOH溶液吸收了;C选项中反应生成的NH3被装置C中的H2O吸收了。
12.某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图,导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
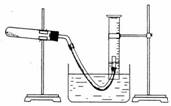
回答下列问题:
(1)如何检查装置的气密性?
;
(2)以下是测量收集到气体体积必须包括的几个步骤;①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是: _______________________________(请填写步骤代号)
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同?
____________________________________________________________。
(4)如果实验中得到的氧气体积是c L(25 ℃、1.01×l05 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含以a、b、c,不必化简):
M(O2)= __________________________________________。
11.某学生进行硫酸铜晶体结晶水含量测定实验,请按下列要求填空。
(1) 本实验需用的玻璃仪器有:
;
(2)做此实验,最少应进行称量操作_____________次;
(3)完成下列部分实验报告
|
m(坩埚)/g |
[m(坩埚)+ m(晶体)]/g |
[m(坩埚)+ m(无水固体)]/g |
CuSO4·xH2O |
|
11.7 |
25.1 |
19.7 |
X= |
(4)该实验中产生误差(x≠5)的原因可能是
___________________。(填序号)
A.硫酸铜晶体中含不挥发性杂质
B.加热过程中有晶体溅出
C.实验前晶体表面有湿存水
D.加热后坩埚直接放在空气中冷却
E.加热时局部温度过高,有部分硫酸铜分解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com