
9.(1)98% (2)8.16mol·L-1
讲析:石灰石分解率是指已分解的占原来总石灰石的百分率。原来总石灰石不包括杂质。
第49课时 (B卷)
纠错训练
8.45mg/Kg 合格
讲析:求算出428g食盐样品中的碘酸钾按题意必须换算为每千克食盐中含碘酸钾的量,再作出判断。
7.(1)2Cu+O2+2H2SO4=2CuSO4+2H2O
(2)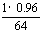 × 250 = 3.75(kg)
× 250 = 3.75(kg)
(3)①2∶5
② CuSO4+ Ca(OH)2= Cu(OH)2+ CaSO4
反应前 2 5 0 0
反应后 1 4 1 1
∴CuSO4·xCu(OH)2·yCa(OH)2中y=4
6.(1)5 5 (2)(a-10)︰(20-a) (3)10<a<20
讲析:注意:在25℃,101kPa条件下,生成的水为液态。
1.D 2.C 3.C 4.BC 5.D
讲析:1.锌与盐酸是否恰好反应,无法确定。以生成的H2作为计算的依据。2.由消耗的盐酸可知生成CuCl2的量,据铜元素守恒,灼烧28.4g样品可得CuO的质量。4.由Al-1.5H2和Mg(Fe)-H2可知三种金属物质的量的取值范围是0.0833mol-0.125mol。5.由题给信息知:还原性H2SO3 > HBr,有一半Br- 变为Br2,则H2SO3已全部被氧化,由电子守恒可求得。
3.(1)设每天消耗固体硫的质量为x,根据硫元素守恒得 x×95%=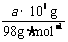 ×32·mol-1×98%
×32·mol-1×98%
x=0.337 a t
(2)每天生产的纯H2SO4的物质的量为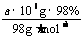 =a×l04mol,因而生产过程中生成的SO2和SO3都是a×l04mol。由于S→SO2,SO2→SO3中所需氧元素均由空气供应,根据氧元素守恒,每天至少消耗空气体积
=a×l04mol,因而生产过程中生成的SO2和SO3都是a×l04mol。由于S→SO2,SO2→SO3中所需氧元素均由空气供应,根据氧元素守恒,每天至少消耗空气体积
V(空气)=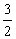 ×a×104mol×22.4L·mol-1×10-3m3·L-1÷21%=1600am3
×a×104mol×22.4L·mol-1×10-3m3·L-1÷21%=1600am3
故理论上至少安装送风机的台数= =
=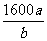 台
台
(3)本小题中“Ψ(O2)的下限”,其含义是指燃烧后剩余的O2在第二步催化氧化时恰好完全反应,即燃烧前空气中的氧恰好满足S+O2=SO2及2SO2+O2 2SO3,两步反应。因上述两步反应的耗O2量之比为2:1,所以燃烧后(第一步反应后)混合气体中O2的体积下限V′=V(空气)x×21%×1/3= V(空气)×7%,由于S+O2=SO2是气体体积不变的反应,故燃烧后混合气体的体积与通人的空气体积y(空气)相等,据此可得:
2SO3,两步反应。因上述两步反应的耗O2量之比为2:1,所以燃烧后(第一步反应后)混合气体中O2的体积下限V′=V(空气)x×21%×1/3= V(空气)×7%,由于S+O2=SO2是气体体积不变的反应,故燃烧后混合气体的体积与通人的空气体积y(空气)相等,据此可得:
Ψ(O2)下限=V(空气)×7%/V(空气)=7%
新活题网站
22.4 a /100(L) <V<22.4 a/84(L)
2.(1)二者以等物质的量混合,可求出二者的质量比。m(NaHCO3)︰m(KHCO3)=84︰100
(2)设盐酸的物质的量浓度为z(mol/L)
NaHCO3+HCl= NaCl+H2O+CO2↑
84 22.4
84a/184 0.1z/2 z=5a/46
如果从KHCO3为基准来计算,可得到同样结果。
(3)盐酸过量时,生成CO2的体积为V:
NaHCO3+HCl= NaCl+H2O+CO2↑
84 22.4
84a/184 V/2
V=22.4a/92(L)或5.6a/23(L)
(4)如果盐酸不足量,则应该用盐酸的量为基准进行计算,这就需要知道盐酸的物质的量浓度。
(5)可以考虑两个极端时的情况,若全部固体为NaHCO3,可放出CO2 22.4 a/84(L),若全部固体为KHCO3,则可放出CO2 22.4 a /100(L),因此体积范围是:
1.NaCl8.700g、KBr0.500g、CaCl20.800g
讲析:正确分析反应前后物质的变化及质量变化对化学计算至关重要,三种盐的混合物通入氯气后溴化钾转变为氯化钾,并造成反应前后固体的质量差(10.000-9.813)g,由差量法可计算出溴化钾的质量;残留物中仅有氯化钙与碳酸钠溶液反应生成碳酸钙沉淀,由碳酸钙的质量计算出氯化钙的质量。
5.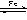 1,2,3,4-四氢化萘的结构简式是
,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2 C10H8Br4+4HBr。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。②慢慢滴入液溴,不断搅拌,直到反应完全。③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。④分液,得到的“水层”即氢溴酸溶液。
1,2,3,4-四氢化萘的结构简式是
,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2 C10H8Br4+4HBr。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。②慢慢滴入液溴,不断搅拌,直到反应完全。③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。④分液,得到的“水层”即氢溴酸溶液。
回答下面问题:
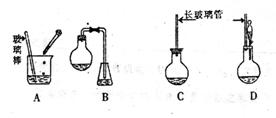
(1)下面示意图中的装置,适合步骤①和②操作的是 ;
(2)步骤②中如何判断“反应完全” ;
(3)步骤③中补充少量四氢化萘的目的是 ;
(4)步骤③中过滤后得到的固体物质是 ;
(5)已知在实验条件下,饱各氢溴酸水溶液中氢溴酸的质量分数是66%,如果溴化反应进行完全,则步骤①中四氢化萘和水的质量比约是1: (保留小数点后1位)。
|
Cu2(OH)2CO3·xH2O 2CuO+CO2↑+(x+1)H2O
现取一定量该粉末(未精确测定质量)样品,用下图所列仪器(夹持、加热等仪器均略)先后进行两个实验:
(Ⅰ)测定该粉末组成中结晶水的x值;
 (Ⅱ)用前一个实验结束后的残留固体与乙醇蒸气反应(该残留固体可使乙醇发生去氢氧化),并检验反应产物。(已知乙醇的沸点为78℃)
(Ⅱ)用前一个实验结束后的残留固体与乙醇蒸气反应(该残留固体可使乙醇发生去氢氧化),并检验反应产物。(已知乙醇的沸点为78℃)
(1)见图中已装配好一套装置,回答下列问题:
①该装置用于进行实验(选填Ⅰ或Ⅱ) ,需加热的仪器有(选填序号字母) ;
②在试管D中所放试剂及可观察到的现象是
,
反应的离子方程式为 ;
③为确保反应物有较高的利用率,且使装置中气流平稳,应对C部分进行的改进是 ;
(2)用图中其它仪器组装完成另一实验的装置,回答以下问题:
①这些仪器按气流从左到右方向的连接顺序是(填写序号字母) → → →H;其中H的作用是 ;
②组装试管F时,试管口应略向下倾斜,其原因是
;
(3)若各装置中的反应都能进行完全,实验后测得A中固体质量减轻ag、E增重bg、G增重cg,则表示结晶水x值的计算式为(从a、b、c中选两个量求算,不必化简)
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com