
1.正确理解化学方程式“质”和“量”两方面的涵义,准确书写化学方程式,并求出相关物质的摩尔质量,这是化学方程式计算的关键。
(1)计算过程:设未知→列化学方程式(或关系式)→找相关物质,列出关系量→列比例式→解未知→答。
(2)注意点:a.反应式所表示的是纯物质的相关量,不纯物质或溶液应先换算为纯物质的量,才可代入计算。
b.可用反应过程中质量变化量(质量差)或体积变化量(体积差)建立比例关系,进行计算。
11.(1)40
(2)2CaSO4·H2O(或CaSO4·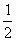 H2O)
H2O)
因为在加热过程中生石膏CaSO4·2H2O转化为相对稳定的2CaSO4·H2O,所以出现了图象中的ab段。
10.(1)0.53
(2)设生成CO2的丁烷有xmol, 生成CO的丁烷有ymol, 则
C4H10+ 6.5O2 = 4CO2+ 5H2O(液)
xmol 6.5xmol 4xmol 5xmol
C4H10 +4.5O2 =4CO + 5H2O(液)
ymol 4.5ymol 4ymol 5ymol
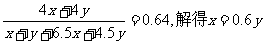
则n(CO2):n(CO):n(H2O)=4x:4y:(5x+5y)=4×0.60y:4y:(5×0.60y+5y)=3:5:10
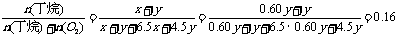
9.(1)一定会发生的反应是:
CuO+H2SO4 CuSO4+H2O
CuSO4+Fe FeSO4+Cu
可能会发生的反应是:H2SO4+Fe FeSO4+H2↑
而n(H2SO4)=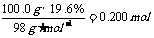
n(Fe)=
由于n(Fe)>n(H2SO4),所以0.200molH2SO4全部转化为FeSO4,而铁粉只被消耗0.200mol,还有剩余。因此干燥后的固体物质是铁和铜的混合物。
(2)剩余铁粉的质量m(Fe,余)=(0.350mol-0.200mol)×56g·mol=8.40g
铜的质量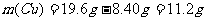
氧化铜的质量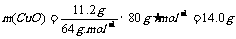
8.(1)
m(S)= 0.2mol/L×0.1L×32g/mol+0.8mol×32g/mol=26.2g
(2)n(Na2SO3)=12.6g÷126g/mol=0.1mol
n(SO2)=0.1mol- 0.2mol/L×0.1L=0.08mol
V(SO2)=0.08mol×22.4L/mol=1.792L 即1792mL
7.发生反应:
3CuSO4+2Al=3Cu+Al2(SO4)3
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al2(SO)3+8NaOH=2NaAlO2+4H2O+3Na2SO4
n(H2)=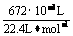 =0.03mol
=0.03mol
n(NaOH)=2 mol·L-1×210×10-3L=0.42 mol
设硫酸铜的物质的量为x
3 CuSO4-2Al-Al2(SO4)3-8NaOH
x 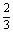 x
x 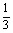 x
x 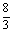 x
x
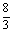 x+0.02=0.42 x=0.15
mol
x+0.02=0.42 x=0.15
mol
则Al粉的质量为:(0.15×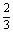 +0.02)×27=3.24g
+0.02)×27=3.24g
原硫酸铜溶液的物质的量浓度为:
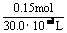 =5 mol·L-1
=5 mol·L-1
1.C 2.B 3.B 4.C 5.A 6.AC
讲析:2.此题中涉及的反应较多,分析不难发现最终的残留物为Fe2O3,且m(Fe2O3)=m(Fe、Al),铁元素质量不变,则m(O)=m(Al)。 4.Zn与浓硫酸发生反应时,随着反应的进行浓硫酸由浓变稀,又发生Zn与稀硫酸的反应,故产生SO2和H2。又由于Zn与浓硫酸反应时,浓硫酸部分被还原,则整个过程中转移的电子物质的总量小于4 mol。5.设短周期金属元素A和B与酸反应产生离子的的化合价为+m和+n,有反应:
2A+2mH+=2Am++mH2↑ 2B+2nH+=2Bn++nH2↑
因A、B等物质的量,且VA≠VB,要确定m、n的值,只要知道VA∶VB的值即可求得。
3.(1)Na2O+H2O===2NaOH
2 Na2O2+2H2O===4NaOH+ O2↑
设Na2O、Na2O2的物质的量分别为x、y。
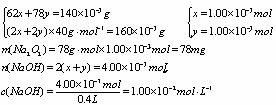
pH=12 (2)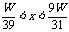
检测提高
2.(1)在t℃和pPa下D气体的密度(ag·L-1),19.5g +11.0g-3.00L×ag·L-1
(2)盐酸的浓度(bmol·L-1)
当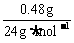 <
<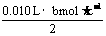 时,V
时,V =
=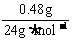 ×22.4L·mol-1
×22.4L·mol-1
当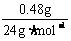 >
>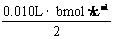 时,V
时,V =
= ×22.4L·mol-1
×22.4L·mol-1
1.B
讲析:设二价金属碳酸盐和碳酸氢盐物质的量分别为x和y,据题意有: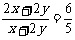
解得:x/y =1:2, 选B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com