
3.将15 L NO2通过水后(未完全反应)可收集到7 L气体(体积均在同温、同压下测定),被氧化的NO2有
A.4 L B.6 L C.8 L D.12 L
(该题旨在考查学生运用差量法进行计算。答题时由反应前后气体体积的差量关系列式计算。)
2.碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,消耗1mol/L盐酸500mL。灼烧等质量的上述混合物,得到氧化铜的质量是
A.35g B.30 g C.20 g D.15 g
(本题考查的是依据反应方程式进行有关计算的问题。答题的关键是利用元素守恒,找出反应物间量的关系。)
1.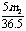
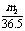
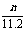
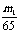 将m1g锌加到m2g20%HCl溶液中去,反应结果共放出nL氢气(在标准状况下),则被还原去的HCl的物质的量是( )
将m1g锌加到m2g20%HCl溶液中去,反应结果共放出nL氢气(在标准状况下),则被还原去的HCl的物质的量是( )
A. mol B. mol C. mol D. mol
(此题考查有关过量计算问题。答题时要认真审题,确定计算依据。)
3.某化工设计院承担新科硫酸厂的设计任务,该厂要求:①为了控制污染和提高生产效率,不再使用黄铁矿,改用固体硫为原料。
②改二次送风(鼓入空气)为一次送风,即送风后使硫充分燃烧,并在下一步催化氧化时不再补充空气。
③每天生产98%H2SO4 a t。
④送风机每天输送空气的体积为b m3/台(标准状况)。
求:(1)每天消耗纯度为95%的固体硫多少吨?
(2)理论上至少应安装多少台送风机?
(3)固体硫充分燃烧后的混合气体中氧气的体积分数ψ(O2)的下限为多少(转化过程不考虑损耗;固体硫中杂质与空气不反应;空气中氧气的体积分数为21%)?
(试题考查的内容涉及硫酸工业生产的基本知识和有关气体摩尔体积、利用反应方程式等的计算。解答此题时要对燃烧反应前后气体体积之间的关系以及对题干中ψ(O2)的下限的含义有清楚的理解,方可列式求算。)
新活题网站
2.( 2002年高考科研试测题)现有等物质的量的NaHCO3、KHCO3的混合物a g与100mL盐酸反应。题中涉及的气体体积均以标准状况计,填空时可以用带字母的公式表示。
(1)该混合物中NaHCO3与KHCO3的质量比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为 mol·L-1。
(3)如果盐酸过量,生成CO2的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道 。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积范围是 。
(本题意在考查学生利用化学方程式,进行有关混合物计算及过量计算。解答此题的关键在于审清题意,正确书写发生反应化学方程式,确定所需反应物之间量的关系,从而求得结果。)
1.(2001年春季高考题)将NaCl、KBr和CaCl2的混合物10.000g溶于水中,通入足量的氯气充分反应,然后把溶液蒸干并灼烧(高温加热),灼热后残留物的质量为9.813g。若将此残留物再溶于水并加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为0.721g。求原混合物中各化合物质量。
(该题考查学生对诸多单质及化合物性质的掌握情况。答题的关键在于正确书写化学方程式,分析反应前后物质的变化及质量变化原因,找出差量关系进行运算。)
5.无数据计算题较特殊,字里行间无任何数据,却要进行计算。这类题型在一定程度上增大了解题的难度和迷惑性,但只要掌握了它的解法,并不难。无数据型计算题的常用解法有等量法、假设法和推理法等。
数据缺省型题目的特点是:构成计算要素的已知量缺省,要求学生根据计算要求补充这一缺省量,然后进行有关计算。数据缺省型计算题是近几年国家命题组开发出来的成功计算题型。此类试题对考查学生逻辑思维能力及学习潜能特别有效。
典型题点击
4.混合物反应的计算是化学计算中的一种最基本的类型。混合物可以是固体、气体或溶液,解题过程中必须仔细审题,理清各物质之间量的关系,必要时可采用图示或简捷的化学用语表示。二元混合物是混合物计算中最重要也是最基本的一种类型,其一般解题思路是:设两个未知数,然后根据有关反应的化学方程式中物质的量关系,列出二元一次方程组求解。
3.多步反应的计算应先写出有关反应的化学方程式,然后找出起始物质与最终物质之间的关系,再用关系式进行计算。此类题目往往涉及物质纯度、转化率、利用率、产率等概念。
2.判断反应物中有一种过量的化学计算题出现较多,其判断的方法因题型(即所给已知条件)不同而不同。常见的方法有常规方法、极端假设法、产物逆推法等,判断的方法灵活多变,具有一定的难度。解此类题时,应先确定哪种反应物过量,必须以不足量的反应物的量求算生成物的量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com