
5.书写和判断与“量”有关的离子方程式时,未能分析出如“过量”、“少量”、“等物质的量”、“适量”、“任意量”以及滴加顺序等对反应方式的影响。
纠错训练
4.只注意质量守恒而忽视了电荷守恒。
3.漏写离子反应,如氢氧化钡溶液与硫酸铜溶液反应,既要写Ba2+与SO42-的离子反应,又要写Cu2+与OH-的离子反应。
2.各物质的符号表达不正确,如HCO3-不能写成H++CO32-,HCOO-不可写成COOH-等;微溶物处于溶液状态时没有写成离子形式,处于浊液或固体时没有写成化学式。
1.离子反应不符合客观事实,主观臆造产物及反应;对未处于自由移动离子状态的物质写成了离子形式。
16.水中着含钙离子(Ca2+)、镁离子(Mg2+)、铁离子(Fe3+)或锰离(Mn2+),则称水为“硬水”.硬水在加热过程中产生沉淀物,不能作为锅炉用水,用作洗涤时会降低去污能力,饮用时口感也欠佳。则以(Ca2+、Mg2+)为主的硬水为例,在水中加消石灰和纯碱的“石灰--苏打软化法”软化硬水的离子反应方程式是:
(1) ;
(2) 。
第4课时 离子反应 ( B卷 )
易错现象
15.已知下列变化过程中,0.2mo1RxO42-离子参加反应时共转移0.4mol电子,
RxO42-+ MnO4-+ H+→RO2 + Mn2++H2O
(1)x值 ;
(2)参加反应的H+的物质的量为 。
(本题考查得失电子守恒在化学计算中的运用,同时注意配平过程中的电荷守恒)
14.现需要检验某溶液中是否存在下列离子:SO42-、SO32-、S2-、CO32-、Cl-、Br-、I-,根据以下事实,分别作出适当的结论。
(1)若溶液呈强酸性,不能以较大浓度存在的离子是
(2)先加盐酸酸化,再加BaCl2溶液无沉淀生成,则不存在的离子是
(3)只加BaCl2溶液,无沉淀生成,则不存在的离子是
(4)加硝酸银溶液和稀硝酸,有白色沉淀生成,则存在的离子是
13.(2002年上海高考题)将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是(D)
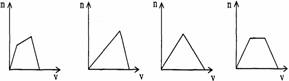
A B C D
(本题考查CO2与KOH和Ca(OH)2的混合液的反应本质过程及其现象)
12.(2002年上海高考题)下列离子方程式书写正确的是( B )
A. FeCl2溶液中通入Cl2 Fe2++Cl2→Fe3++2Cl-
B. 澄清石灰水与少量小苏打溶液混合 Ca2++OH-+HCO3-→CaCO3↓+H2O
C.FeS固体放人稀硝酸溶液中FeS+2H+→Fe2++H2S↑
D.AlCl3溶液中加入过量氨水 Al3++4OH-→AlO2-+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com