
3.讨论型的综合计算包括过量计算讨论、过程讨论、不定方程讨论,他们都可归结为范围讨论计算,此类题融化学原理、元素化合物知识、数据分析、逻辑推理于化学计算之中,技巧性强,方法灵活,因而是高考的热点和难点。范围讨论计算所依据的化学原理是反应物之间相对含量或浓度不同而产物不同(如NaOH与CO2反应、Na2O2与NaHCO3共热、Cu与HNO3反应、FeO与C反应等),所以,此类题实际上是过量计算的演化和延伸。解题方法思路是:
(1)写方程式、找完全点。即写出因反应物相对量不同而可以发生的化学反应方程式,并分别计算找出二者恰好完全反应时的特殊点。
(2)确定范围、计算判断。即以恰好完全反应的点为基准,讨论大于、小于或等于的情况,从而划出相应的区间,确定不同范围,进行相对过量计算即可。
2.假设法的综合计算包括极端假设、过程假设、赋值假设等。其中极端假设思想运用较多,采取极端假设可把问题或过程推向极限,使复杂的问题变得单一化、极端化和简单化,通过对极端问题的讨论,使思路清晰,过程简明,从而迅速准确地得到正确答案。常用于混合物的计算、化学平衡、平行反应等。
1.利用化学方程式、关系式的综合计算:此类计算可能涉及到许多反应,存在多种变化关系,关键是抓住始态和终态,写出关系式(一般采用物质的量之比),一次列式求解,而不必对每一步反应都进行计算。正确提取关系式是用关系式法解题的关键,提取关系式的常用方法有:
①从化学方程式中提取关系式;
②从化学式和电极反应式等中提取关系式;
③从物质和对应的差量(质量差、体积差、物质的量差、浓度差等)之间提取关系式。
也可依据反应过程中某一元素的存在形式,结合二元代数方程,运用守恒法(如质量守恒、元素守恒、电荷守恒、得失电子守恒等)列出关系解题。
12.
(1)CxHy+(x/2+y/4+m/2)O2 mCO2+y/2H2O+ (x-m)CO
mCO2+y/2H2O+ (x-m)CO
(2)当m=2时,该烃分子式为C4H8
(3)
|
烃的分子式 |
n(CO)/n(CO2) |
|
C3H8 |
1/2 |
|
C4H6 |
1/3 |
讲析:
(1)CxHy+(x/2+y/4+m/2)O2→mCO2+y/2H2O+ (x-m)CO
(2)通过Na2O2 mCO2 m/2O2,y/2H2O
m/2O2,y/2H2O y/4O2,(x-m)CO
y/4O2,(x-m)CO (x-m)/2O2
(x-m)/2O2
x/2+y/4+1=5
当m=2时  =5/8
=5/8
解得:x=4 y=8 分子式:C4H8
(3)讨论:固体质量总增重:ΔW=ΔW(CO2) +ΔW(H2O) +ΔW(CO)=28m+y+28(x-m)=28x+y
①根据Na2O2的增重:90≤28x+y≤118
讨论气态烃中:x=3时,6≤y≤8 x=4时y≤6
此条件下合理答案有:C4H6、C4H4、C3H8、C3H6
②根据燃烧产物通过足量Na2O2产生O2体积为3 mol,
 =3,因x>m,则x>6-y/2
=3,因x>m,则x>6-y/2
讨论得气态烃中:x=3时,y>6 x=4时,y>4
根据①②条件需同时满足,从而否定C4H4、C3H6,该烃可能为C3H8、C4H6
再由 =3,得y=8时,m=2
=3,得y=8时,m=2  =1/2
=1/2
y=6时,m=3  =1/3
=1/3
11.四个数据中取两个,但必须涉及到Cu元素的质量,这样排除了W(H2O)、V(H2)这种组合,故5种。
(1)2,5
|
W、W(Cu) |
W、W(H2O) |
W、V(H2) |
W(Cu) 、W(H2O)
|
|
W(Cu)、V(H2) |
|
|
|
(2)
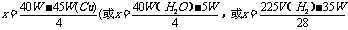
0.05mol 0.025mol 0.1mol 则产生气体为氯气0.05mol;氧气0.025mol。
c(H+) = 0.1mol/L,pH = 1
(2)阴极产物为:n(Cu) = 0.2xmol , n(H2) = 0.16mol 阳极产物为:n(Cl2) = 0.1(1-x)mol, n(O2) = [0.16-0.1(1-x)]mol
依据电子守衡:x = 0.6
0.05mol 0.1mol 0.05mol 余Cu2+ 0.05mol
2Cu2+-------4OH- --------O2 ----------------4H+
10.(1) n(Cu2+) = 0.1mol;n(Cl-) = 0.1mol
Cu2+ -------2Cl---------Cl2
0. 15 0.15
15 0.15
=2.5 mol/L
0.15 0.15
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com