
15.下图表示的是难溶氢氧化物在不同pH下的溶解度(S,mol/L),下列说法中正确的是 ( )

A.pH=3时溶液中铁元素的主要存在形式是Fe3+
B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去
C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右
D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
解析:由图可知在pH=3时Fe3+已沉淀完全,铁元素的主要存在形式是Fe(OH)3,A错误.由于Ni2+和Co2+沉淀完全的pH相差不大,因此不能用调节pH的方法将两者分离,B错误.由图可知选项D中优先沉淀的是Cu(OH)2,D错误.
答案:C
14.(2009·宁夏高考)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,错误的是 ( )
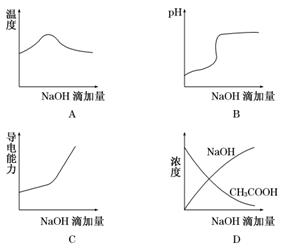
解析:向醋酸中滴加NaOH溶液,起始时发生中和反应放出热量,反应混合液的温度升高,恰好全部反应时,溶液的温度达到最高点,当醋酸全部反应后,再加入NaOH溶液则混合液的温度降低;向醋酸中滴加NaOH溶液,起始时溶液的pH会缓慢升高,在接近终点时pH发生突跃,随后再滴加NaOH溶液,溶液的pH(此时显碱性)变化不大;因醋酸是弱电解质,溶液中离子浓度小,导电能力弱,当向醋酸中滴加NaOH溶液时生成强电解质醋酸钠,溶液的导电能力增强,当反应结束时离子浓度增加幅度更大,导电能力更强;向醋酸中滴加NaOH溶液,起始时加入的NaOH被消耗,故c(NaOH)在起始一段时间内应为0,且反应结束后c(NaOH)呈基本水平走势.
答案:D
13.(2009·日照模拟)人体血液的正常pH约为7.35-7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险.由于人体体液的缓冲系统中存在如下平衡:
H++HCO H2CO3
H2CO3 CO2+H2O
CO2+H2O
H++PO HPO
HPO
H++HPO H2PO
H2PO
故能维持血液pH的相对稳定,以保证正常生理活动.下列说法中不合理的是( )
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人静脉滴注生理盐水后,血液被稀释,会导致c(H+)显著减小,pH显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小
解析:正常机体可通过体内的缓冲物质使机体的pH相对稳定,不会对机体造成不良影响.
答案:C
12.(2009·上海高考·有改动)对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
A.该溶液1 mL稀释至100 mL后,pH等于2
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
解析:将pH=1的硝酸稀释100倍,溶液中c(H+)=10-3mol/L,pH变为3,A错误;pH=1的硝酸中c(H+)与pH=13的Ba(OH)2溶液中c(OH-)相等二者恰好发生中和反应,B正确;pH=1的硝酸中由硝酸电离出的c(H+)与水电离出的c(H+)之比为10-1/10-13=1012,C错误;pH=1的硝酸中水电离出的c(H+)=10-13 mol/L,pH=3的硝酸中由水电离出的c(H+)=10-11 mol/L,故该溶液中由水电离出的c(H+)是pH=3的硝酸中水电离出c(H+)的1/100.D错误.
答案:B
11.已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是 ( )
A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L
C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生
D.除去工业废水中的Cu2+可以选用FeS作沉淀剂
解析:向H2S的饱和溶液中通入少量SO2气体,因发生反应:2H2S+SO2===3S↓+2H2O,使溶液酸性减弱,A错误;由于CuSO4是足量的,S2-因生成CuS沉淀而消耗导致其浓度非常小,Cu2+的浓度可以接近饱和溶液中Cu2+的浓度,B错误;因CuS沉淀不溶于硫酸,所以反应CuSO4+H2S===CuS↓+H2SO4可以发生,C错误;由FeS、CuS的溶度积常数知,FeS的溶解度大于CuS,可实现沉淀的转化,故除去工业废水中的Cu2+可以选用FeS作沉淀剂,D正确.
答案:D
10.某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是 ( )
|
编号 |
HX |
YOH |
溶液的体积关系 |
|
① |
强酸 |
强碱 |
V(HX)=V(YOH) |
|
② |
强酸 |
强碱 |
V(HX)<V(YOH) |
|
③ |
强酸 |
弱碱 |
V(HX)=V(YOH) |
|
④ |
弱酸 |
强碱 |
V(HX)=V(YOH) |
A.①③ B.②③
C.①④ D.②④
解析:反应后的溶液呈碱性,其原因可能是生成的盐YX发生水解,即X-+H2O HX+OH-,或者是反应后碱过量,c·V(HX)<c·V(YOH),即V(HX)<V(YOH),故选D.
HX+OH-,或者是反应后碱过量,c·V(HX)<c·V(YOH),即V(HX)<V(YOH),故选D.
答案:D
9.(2009·海南高考)已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是 ( )
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
解析:HA溶液中c(H+)=0.1 mol/L×0.1%=10-4 mol/L,因此pH=4,A正确;弱酸的电离吸热,升高温度,电离平衡向正方向移动,溶液中c(H+)增大,pH减小,B错误;室温时0.1 mol/L HA溶液中c(H+)=c(A-)=10-4 mol/L,电离平衡常数K===10-7,C正确;该溶液中c(H+)=10-4 mol/L、c(OH-)=10-10 mol/L,由HA电离出c(H+)=10-4 mol/L,由水电离出的c(H+)=10-10mol/L,D正确.
答案:B
8.(2010·北京海淀期中检测)常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是 ( )
A.溶液中由水电离产生的H+浓度为1×10-7 mol/L
B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L
C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
解析:混合后溶液中为等物质的量的CH3COONa和CH3COOH,pH<7,说明CH3COOH的电离程大于CH3COONa的水解程度,C选项错误;酸性条件下水的电离受到抑制,A选项错误;D选项不符合电荷守恒;由物料守恒可知,混合后的溶液中,c(CH3COO-)+c(CH3COOH)=0.1 mol/L,c(Na+)=0.05 mol/L,则B选项正确.
答案:B
7.(2010·无锡检测)在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是 ( )
A.1∶9 B.1∶1
C.1∶2 D.1∶4
解析:设Ba(OH)2溶液的体积为V1,NaHSO4溶液的体积为V2,NaHSO4溶液的物质的量浓度为c2,由Ba2++SO===BaSO4↓得如下关系:
×10-2 mol/L×V1=V2×c2 ①
又由混合后溶液的pH=11,得出如下关系:
=10-3 mol/L ②
综合①②可得:V1∶V2=1∶4.
答案:D
6.已知某酸H2B在水溶液中存在下列关系:
①H2B H++HB-,②HB-
H++HB-,②HB- H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是
( )
H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是
( )
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.c(Na+)=c(HB-)+c(B2-)+c(H2B)
D.NaHB和NaOH溶液反应的离子方程式为H++OH-===H2O
解析:NaHB属于强电解质,A项错;由于HB-的电离程度和水解程度大小未知,所以NaHB溶液的酸碱性不确定,B项错;C项表达的是物料守恒,正确;由于HB-只有部分电离,所以写离子方程式时不能拆写为H+,D项错.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com