
3.下列各组物质按氧化物、混合物、单质顺序排列的一组是
A.干冰、空气、黄铜 B.甲烷、加碘盐、液氧
C.过氧化氢、食醋、 水银 D.石灰石、天然气、铁粉
2.具备基本的化学实验技能是进行科学探究活动的基础和保证。下列有关实验操作错误的是
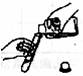
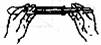
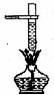
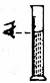
A.倾倒液体 B.装入固体粉末 C.加热液体 D.读取液体体积
1.2008年8月8日晚8时,第29届奥林匹克运动会在北京“鸟巢”主会场开幕。下列情景中蕴含着化学变化的是
A.彩旗飘扬 B.声音远扬 C.火炬燃烧 D.气球升空
22.(8分)以下是25℃时几种难溶电解质的溶解度:
|
难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为____________(填化学式)而除去.
(2)①中加入的试剂应该选择________为宜,其原因是__________________.
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________.
(4)下列与方案③相关的叙述中,正确的是________(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
解析:①中加入氨水,利用沉淀的生成,将Fe3+转化为Fe(OH)3沉淀;②中加入氢氧化镁,利用沉淀的转化,将Fe3+转化为Fe(OH)3沉淀,③中先加入H2O2,将Fe2+氧化成Fe3+,然后调节溶液pH,使Fe3+转化为Fe(OH)3沉淀.
答案:(1)Fe(OH)3 (2)氨水 不会引入新的杂质
(3)2Fe3++3Mg(OH)2===3Mg2++2Fe(OH)3
(4)ACDE
21.(9分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g.
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀.
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察______.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______色变成_____________________色.
(2)滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
|
|
|
|
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.101 0 mol/L,则该样品中氮的质量分数为________.
解析:滴定过程中,应在边滴边摇动锥形瓶的同时,边注视锥形瓶内溶液颜色的变化.当溶液颜色由无色变粉红色时且半分钟内不再变色,表明已达到滴定终点;由4NH+6HCHO===3H++6H2O+(CH2)6N4H+;H++OH-===H2O,及题给信息知:NH-OH-,即V(NH)·c(NH)=V(NaOH)·c(NaOH);碱式滴式管不润洗就加入标准液使c(NaOH)降低,消耗NaOH溶液体积增大,n(NH)增大,结果偏高.锥形瓶中有水对结果没有影响.三次实验消耗NaOH溶液的平均体积为:
=20.00 mL;25.00 mL待测液中含n(NH)=2.02×10-3 mol,样品中含氮的质量分数为:
×100%=18.85%.
答案:(1)①偏高 ②无影响 ③B ④无 粉红(或浅红)
(2)18.85%
20.(9分)(1)向Na2CO3的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则在此过程中,溶液的c(HCO)变化趋势可能是:①逐渐减小;②逐渐增大;③先逐渐增大,而后减小;④先逐渐减小,而后增大.4种趋势中可能的是________.
(2)pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液各100 mL.
①3种溶液中,物质的量浓度最大的是________.
②分别用0.1 mol/L的NaOH溶液中和,其中消耗NaOH溶液最多的是________.
③与等量的锌粉反应,反应开始时,反应速率________.
A.HCl最快 B.H2SO4最快
C.CH3COOH最快 D.一样快
(3)某温度下,纯水中c(H+)=2.0×10-7 mol/L,则此时c(OH-)=______mol/L.相同条件下,测得:①NaHCO3溶液,②CH3COONa溶液,③NaClO溶液,3种稀溶液的pH相同,那么,它们的物质的量浓度由小到大的顺序是________________________.
解析:(1)先后发生的反应为CO+H+===HCO,HCO+H+===H2O+CO2↑,所以c(HCO)先逐渐变大后又逐渐变小.
(2)同pH时,CH3COOH是弱酸,其物质的量浓度最大,与NaOH反应时,消耗的NaOH最多.由于c(H+)相等,与Zn作用时开始的瞬间反应速率是相等的.
(3)纯水中水电离的H+和OH-的浓度相等,故c(OH-)=2×10-7mol/L;因为酸性HClO<H2CO3<CH3COOH,所以pH相同时,物质的量浓度应为NaClO<NaHCO3<CH3COONa.
答案:(1)③ (2)①CH3COOH ②CH3COOH ③D
(3)2×10-7 NaClO<NaHCO3<CH3COONa
19.(8分)(1)将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=______.(溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合而得,则溶液的pH________7.
②若溶液pH>7,则c(Na+)________c(A-),理由是
_____________________________________________________________________
_______________________________________________________________________.
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是______(填选项代号).
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
解析:(1)根据混合所得溶液的pH为1,可得:=10-1 mol/L,解得
V1∶V2=1∶1;
(2)①0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合时,若HA是强酸,则得到的溶液显中性,pH=7,若HA是弱酸,则得到是强碱弱酸盐,溶液显碱性,pH>7;②根据电荷守恒,c(H+)+c(Na+)=c(OH-)+c(A-),若溶液pH>7,即c(OH-)>c(H+),则c(Na+)>c(A-);③若反应后溶液呈中性,则c(H+)=c(OH-)=1×10-7mol/L,c(H+)+c(OH-)=2×10-7 mol/L,A正确;若HA是强酸,得到的溶液显中性,pH=7,若HA是弱酸,则得到的盐水解使溶液显碱性,pH>7,B错误;若反应后溶液呈酸性,如果HA是强酸,则V1一定大于V2,但是如果HA是弱酸,则V1等于或小于V2时,也可满足中和后,HA有剩余而使溶液显酸性,C错误.若反应后溶液呈碱性,如果HA是强酸,说明NaOH过量,V1一定小于V2,若HA是弱酸,HA不完全电离,未电离部分也消耗NaOH,侧面说明V1一定小于V2.
答案:(1)1∶1
(2)①≥ ②> 根据电荷守恒:c(H+)+c(Na+)=c(OH-)+c(A-),由于c(OH-)>c(H+),故c(Na+)>c(A-) ③AD
18.(9分)(2009·皖西四校模拟)分析、归纳、探究是学习化学的重要方法和手段之一.下面就电解质A回答有关问题(假定以下都是室温时的溶液).
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a.
①试说明HnB的酸性强弱_______________________________________.
②当a=10时,A溶液呈碱性的原因是(用离子方式程式表示)________________.
③当a=10、n=1时,A溶液中各种离子浓度由大到小的顺序为____________________________________________________________________.
c(OH-)-c(HB)=________.
④当n=1、c=0.1、溶液中c(HB)∶c(B-)=1∶99时,A溶液的pH为__________(保留整数值).
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρ g/cm3,Xm+离子的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=__________________________,该温度下XnYm的溶解度S=____________.
解析:(1)①若a=7,说明NanB为强酸强碱盐,HnB为强酸;若a>7,说明盐NanB发生水解,则HnB为弱酸.
②当a=10时,HnB为弱酸,Bn-发生水解反应,即Bn-+H2O HB(n-1)-+OH-.
HB(n-1)-+OH-.
③当a=10,n=1时,NaB溶液中存在以下平衡:B-+H2O HB+OH-,H2O
HB+OH-,H2O H++OH-,而B-的水解较微弱,其离子浓度大小关系为:c(Na+)>c(B-)>c(OH-)>c(H+),由B-―→HB,OH-H2O―→H3O+得质子守恒关系式c(OH-)=c(HB)+c(H+),所以c(OH-)-c(HB)=c(H+)=10-10 mol/L
H++OH-,而B-的水解较微弱,其离子浓度大小关系为:c(Na+)>c(B-)>c(OH-)>c(H+),由B-―→HB,OH-H2O―→H3O+得质子守恒关系式c(OH-)=c(HB)+c(H+),所以c(OH-)-c(HB)=c(H+)=10-10 mol/L
④可设溶液B-水解x mol/L,则有=1∶99,得x=0.001 mol/L,故c(OH-)=0.001 mol/L,溶液中c(H+)==1×10-11(mol/L),即pH=11.
(2)由XnYm nXm++mYn-可知当c(Xm+)=c mol/L时,c(Yn-)=c mol/L,则Ksp=cn(Xm+)·cm(Yn-)=cn·()m=()m·cm+n.
nXm++mYn-可知当c(Xm+)=c mol/L时,c(Yn-)=c mol/L,则Ksp=cn(Xm+)·cm(Yn-)=cn·()m=()m·cm+n.
设XnYm溶液体积为1 L,则溶解XnYm mol达到饱和,由=,得S=.
答案:(1)①当a=7时,HnB为强酸,当a>7时HnB为弱酸
②Bn-+H2O HB(n-1)-+OH-
HB(n-1)-+OH-
③c(Na+)>c(B-)>c(OH-)>c(H+) 10-10 mol/L
④11
(2)()m·cm+n
17.(9分)某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH为11,则该温度下水的Kw=________,该温度________25℃(填“大于”“小于”或“等于”),其理由是________________________________________________________________________
________________________________________________________________________.
此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得溶液为中性,且a=12,b=2,则Va∶Vb=____________;
(2)若所得溶液为中性,且a+b=12,则Va∶Vb=________;
(3)若所得溶液的pH=10,且a=12,b=2,则Va∶Vb=______________.
解析:在t℃时,pH=11的溶液中c(H+)=10-11 mol/L,KW=c(H+)·c(OH-)=10-11×10-2=10-13.
(1)pH=a,则c(OH-)=10a-13 mol/L,pH=b,则c(H+)=10-b mol/L,若混合后溶液呈中性,则:Va L×10a-13 mol/L=Vb L×10-b mol/L,==1013-(a+b).因为a=12,b=2,代入可得=.
(2)将a+b=12代入=1013-(a+b)可得=10.
(3)当a=12时,c(OH-)=0.1 mol/L,b=2时,c(H+)=10-2 mol/L,若混合液的pH=10,即c(OH-)=10-3 mol/L,OH-有剩余:0.1 mol/L×Va L-10-2 mol/L×Vb L=10-3 mol/L×(Va+Vb) L,=.
答案:10-13 大于 水的电离是吸热的,升温时水的电离平衡向右移动,KW增大,因该温度下的KW大于25℃时水的KW,所以该温度大于25℃
(1)1∶10
(2)10∶1
(3)1∶9
16.(2009·安徽高考)向体积为Va的0.05 mol/L CH3COOH溶液中加入体积为Vb的0.05 mol/L KOH溶液,下列关系错误的是 ( )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
解析:若Va>Vb,醋酸过量,根据物料守恒可知,n(CH3COOH)+n(CH3COO-)=0.05Va,n(K+)=0.05Vb,A正确;若Va=Vb,反应后的溶液为CH3COOK溶液,由于CH3COO-的水解而显碱性,根据质子守恒可知,B正确;若Va<Vb,说明碱过量,存在c(K+)>c(CH3COO-),C错误;D选项符合电荷守恒,正确.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com