
4.下列各句中,没有语病的一项是
A.中药染发和化学染发有着完全不同的操作程度,它可能要稍微慢一点,但毕竟健康,效果也差不多,而且还在不断更新和改良。
B.提出著名的“公共池塘理论”的印第安纳大学教授奥斯特罗姆,是第一位获得诺贝尔经济学奖的女性。她研究的目的是为了建立合适的制度,从而更合理地使用公共资源。
C.今年的烟花大会首次尝试了“民间烟花大会”的举办模式,邀请市民参与燃放烟花,这不仅是烟花大会的一次全新突破,更是西博会亲民办会、办会乐民的一项重大创新。
D.王菲亮相春节晚会是歌舞类节目中观众期望值较高的节目,她在春晚唱什么歌曲一直被春晚剧组视为最高机密。
3.下列各句中,加点的成语使用恰当的一项是
A.对于孩子的毛病,他总是不以为然,觉得这些毛病无关紧要,不必大惊小怪。
B.作为一名演员,最大的快慰莫过于自己的表演能和观众的情感融会贯通。
C.即将退休的张师傅对自己的徒弟们说:“我已经成为明日黄花了,你们要好好干,公司将来的辉煌业绩要靠你们去创造。
D.在道德日益滑坡的今天,我们对于好人好事就要大张旗鼓,不遗余力地宣传,以此来努力扭转不良的社会风气。
2.下列各句中没有错别字的一项是
A.今年月饼包装虽然瘦了身,但月饼券折扣“漫天飞扬”,各种形式的推销近乎疯狂,中秋月饼销售市场急待整治规范。
B. 他们在明信片背面写下精彩纷呈的题词,赋予这些看似普通的明信片以全新的生命。
C.任何制度的出台,都意味着新的利益搏弈将要开始。对电视购物行业重新设立准入门槛,自然会触动一些地方广电机构的利益。
D.这种文化气息不是简单的拼接,而是纠缠交错、交相融合在一起,是在绘画技巧和文化内涵上的溶铸和提炼。
1.下列各组词语中,每对加点字的读音全部相同的一组是
A.落枕/烙印 攻讦/桀骜 讥诮/翘首 蹒跚/心宽体胖
B.靓妆/强劲 寒暄/煊赫 狡黠/狎昵 妍媸/吹毛求疵
C.菲薄/斐然 糜烂/靡费 星宿/山岫 赦免/拾级而上
D.窠臼/苛责 解数/解读 鳜鱼/刽子手 棋枰/暴虎冯河
20.(2009·福建)短周期元素Q、R、T、W在元 素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
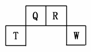
(1)T的原子结构示意图为__________________________________________________。
(2)元素的非金属性(原子的得电子能力)为:Q________(填“强于”或“弱于”)W。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为___________ _________________________
_________________________ ________。
________。
(4)原子序数比R多1的元素的一种氢化物,能分解为它的另一种氢化物,此分解反应的化学方程式是
________________________________________________________________________。
(5)R有多种氧化物,其中甲的相对分子质量最小。在 一定条件下,2L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是___________________________________________________。
一定条件下,2L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是___________________________________________________。
(6)在298 K下,Q、T的单质各1 mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3 mol Q的单质,则该反应在298 K下的ΔH=________(注:题中所设单质均为最稳定单质)
解析:由信息可知,T为第3周期ⅢA族元素,即为Al: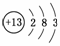 ,Q,R,W分别为C、N、S,则(1)、(2)、(3)、(4)易解答;(5)中N的氧化物中相对分子质量最小的为NO,(6)C(s)+O2(g)===CO2(g);ΔH=-a kJ/mol,……①
,Q,R,W分别为C、N、S,则(1)、(2)、(3)、(4)易解答;(5)中N的氧化物中相对分子质量最小的为NO,(6)C(s)+O2(g)===CO2(g);ΔH=-a kJ/mol,……①
Al(s)+O2(g)===Al2O3(s);ΔH=-b kJ/mol,……②
则反应4Al(s)+3CO2(g)===3C(s)+2Al2O3(s)为ΔH=②×4-①×3=(3a-4b)kJ/mol。
答案:(1)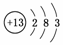 (2)弱于
(2)弱于
(3)S+2H2SO4(浓)3SO2↑+2H2O
(4)2H2O22H2O+O2↑
(5)NaNO2
(6)(3a-4b) kJ·mol-1
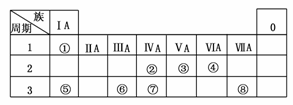
19.(2009·天津)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④⑤⑥的原子半径由大到小的顺序是________________________________ ____。
____。
(2)②③⑦的最高价含氧酸的酸性由强到弱的顺序是
________________________________________________________________________。
(3)①④⑤⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
______________________________________________________ __________________。
__________________。
(4)由表中两种元素的原子按1?1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为________________________________________,
N→⑥的单质的化学方程式为_______________________________________________,
常温下,为使0.1 mol/L M溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至
________________________________________________________________________。
解析: 据元素的位置可知,①-⑧元素依次为H、C、N、O、Na、Al、Si、Cl,再对号入座,其中(5)由框图可确定N为Al2O3,Z为Al(OH)3。M应为NH4Cl,则X、Y为AlCl3、NH3·H2O,为使NH4Cl中由NH4Cl电离出的c(NH)=c(Cl-)可加入NH3·H2O(Y)至溶液pH等于7。
据元素的位置可知,①-⑧元素依次为H、C、N、O、Na、Al、Si、Cl,再对号入座,其中(5)由框图可确定N为Al2O3,Z为Al(OH)3。M应为NH4Cl,则X、Y为AlCl3、NH3·H2O,为使NH4Cl中由NH4Cl电离出的c(NH)=c(Cl-)可加入NH3·H2O(Y)至溶液pH等于7。
答案:(1)Na>Al>O (2)HNO3>H2CO3>H2SiO3
(3)Na+[∶····‖H]-(或Na+[∶····∶····∶]-)
(4)a、b (5)Al3++3NH3·H2O===Al(OH)3↓+3NH
2Al2O3(熔融)电解冰晶石4Al+3O2↑ 溶液的pH等于7
18.已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如下所示的转化关系。
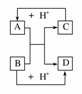
(1)如果A、B、C、D均是10电子的微粒,请写出:A的结构式________;D的电子式________。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式_______________________________________。
②根据上述离子方程式,可判断C与B结合质子的能力大小是(用化学式或离子符号表示)________>________。
(3)已知肼(H2N-NH2)和甲胺(CH3-NH2)都是18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):________。
解析:(1)观察框图,容易想到NH+OH-NH3+H2O或HF+OH-===F-+H2O反应。
(2)①18电子微粒很多,酸碱中和是容易想到的:H2S+OH-===HS-+H2O或HS-+OH-===S2-+H2O。②联想强酸制弱酸的道理,可得到强碱制弱碱,结合质子的能力显然B>C。
(3)按C、H、O、F替换即可。
答案:(1)  或H-F H∶····∶H
或H-F H∶····∶H
(2)①H2S+OH-===HS-+H2O或HS-+OH-===S2-+H2O ②OH- S2-(或HS-)
(3)CH3-CH3,CH3-OH,CH3-F
17.(2009·江苏)X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 ( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
解析:据“X的原子半径最小”可知X为H元素;据“Y原子最外层电子数是次外层电子数的3倍”可知Y原子结构示意图为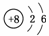 ,即Y为O元素,R与Y同一主族且属短周期元素,所以R是S元素;Z、W两元素与R同周期,且Z、W原子的核外电子数之和等于8+16=24,所以Z只能为11号元素Na,W只能为13号元素Al。A项中O2-、Na+、Al3+的离子半径依次减小;B项中H元素与O元素可以形成化合物H2O2;C项中氢化物的热稳定性H2O>H2S;D项中W对应的Al(OH)3为两性氢氧化物。
,即Y为O元素,R与Y同一主族且属短周期元素,所以R是S元素;Z、W两元素与R同周期,且Z、W原子的核外电子数之和等于8+16=24,所以Z只能为11号元素Na,W只能为13号元素Al。A项中O2-、Na+、Al3+的离子半径依次减小;B项中H元素与O元素可以形成化合物H2O2;C项中氢化物的热稳定性H2O>H2S;D项中W对应的Al(OH)3为两性氢氧化物。
答案:C
16.(2009·北京)W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7?17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是 ( )
A.金属性:Y>Z
B.氢化物的沸点:X>W
C.离子的还原性:X>W
D.原子及离子半径:Z>Y>X
解析:W为氯元素(Cl),X为氟元素(F),Y为铝元素(Al),Z为钠元素(Na),则B项:因HF分子间有氢键,沸点HF>HCl,D项:原子半径符合,而离子半径应为F->Na+>Al3+。
答案:B
15.(2009·山东)元素在元素周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是 ( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
解析:A项如碘元素可形成FeI2(非金属性)、I(NO3)3(金属性),C项如Li+、Be2+为2电子。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com