
2.不能正确判断晶体类型,不能将晶体的物理性质与晶体结构微粒间相互作用力的强弱联系起来进行分析比较。同时也可能出现化学用语的表达如电子式的书写错误。
1.化学键和晶体的概念模糊,既不能在分析解答过程中揭示问题的隐含性,也不能结合具体实例来判断。
15.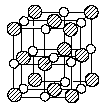 最近发现一种由钛原子(Ti)和碳原子(C)构成的气态复杂分子(如右图所示),顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是
。
最近发现一种由钛原子(Ti)和碳原子(C)构成的气态复杂分子(如右图所示),顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是
。
(本题考查晶体结构与化学式的关系,答题时注意本题的对象是分子)
第10课时 化学键 物质结构(B卷)
易错现象
14.将H2S、HF、HCl、HI、CH4、NH3、H2O、MgO、SiO2、CO2、SO2、NaCl、NaOH、NaHCO3等化合物按以下要求填空: (1)具有强极性键的弱酸是 ,具有强极性键的强酸是 ‚ ,具有弱极性键的强酸是 ƒ ,具有弱极性键的弱酸是 „ ,其水溶液有强碱性的是 … ,其水溶液有弱碱性的是 † 。
(2)属于离子化合物的是 ,其中只有离子键的化合物的电子式为 ‚ 。
(3)属于分子晶体的氧化物是 ,属于原子晶体的氧化物是 ‚ 。
(4)具有正四面体构型的化合物是 ,键角略大于90°的化合物是 ‚ ,难溶于水的气态氢化物是 ƒ ,难溶于水的氧化物是 „ 。
(本题综合考查键的极性,晶体类型,物质的溶解性、分子空间构型和化学用语等方面的知识,答题时注意结构决定性质的关系)
13.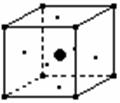 某离子晶体中,存在着A(位于八个顶点)、B(位于正六面体中的六个面上)、C(位于体心)三种元素的原子,其晶体结构中具有代表性的最小重复单位的排列方式如图所示:
某离子晶体中,存在着A(位于八个顶点)、B(位于正六面体中的六个面上)、C(位于体心)三种元素的原子,其晶体结构中具有代表性的最小重复单位的排列方式如图所示:
则该晶体中A、B、C三种原子的个数比是( )
A. 8︰6︰1 B. 1︰1︰1
C. 1︰3︰1 D. 2︰3︰1
(本题考查晶体结构与化学式的关系,答题时注意本题的对象是离子晶体)
12.下表给出几种氯化物的熔沸点,对此有下列说法:
①CaCl2属于离子晶体 ②SiCl4是分子晶体
③1500℃时,NaCl可形成气态分子
④MgCl2水溶液不能导电
|
|
NaCl |
MgCl2 |
CaCl2 |
SiCl4 |
|
熔点(℃) |
801 |
712 |
782 |
-68 |
|
沸点(℃) |
1465 |
1418 |
1600 |
57 |
与表中数据一致的说法有 ( )
A. 仅① B. 仅② C. ①和② D. ①、②和③
(本题考查氯化物的熔沸点与晶体类型的关系,注意结构与性质的关系)
11.已知氯化铝易溶于苯和乙醚,其熔点为190℃,则下列结论错误的是 ( )
A 氯化铝是电解质
B 固体氯化铝是分子晶体
C 可用电解熔融氯化铝的办法制取金属铝
D 氯化铝为非极性分子
(本题考查AlCl3的结构和性质,注意氯化铝为非极性分子)
10.美国Lawtcce Lirermre国家实验室(LLNL)的V·Lota·C·S·Yoo和H·Cynn成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2原子晶体的说法正确的是 ( ) ( )
A.CO2的原子晶体和分子晶体互为同素异形体
B.在一定条件下,CO2原子晶体转化为分子晶体是物理变化
C.CO2的原子晶体和CO2分子晶体具有相同的物理性质
D.在CO2的原子晶体中,每一个碳原子周围结合4个氧
原子,每一个氧原子跟两个碳原子相结合
(本题考查原子晶体的结构特征和性质,答题时注意与SiO2的结构和性质进行比较)
9.最近科学界合成一种“二重结构”的球形物质分子,是把足球型C60分子容纳在足球型Si60分子中,外面的硅原子与里面的碳原子以共价健结合。下列关于这种物质的叙述中
正确的是 ( ) ( )
A.是混合物 B.是化合物
C.不含极性键 D.含有离子键
(本题考查物质类别的判断,答题时注意结构和类别的关系)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com