
11.有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
|
第一组 |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
|
第二组 |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2 184.0 |
|
第三组 |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
第四组 |
H2O 100.0 |
H2S -60.2 |
(d) -42.0 |
H2Te -1.8 |
下列各项中正确的是[ D]
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为C分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te

9.(淮阳一高09高三一轮复习月考(11月份)(15分) A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,其中只有一种是金属元素,C元素原子最外层电子数是D元素原子最外层电子数的一半,B元素原子的最外层电子数比D的少两个。E也是短周期元素,与D同主族。
(1)写出A、B、E三种元素的元素符号:A: B: E: 。
(2)五种元素中的三种组成的易溶于水的物质中,能促进水电离的物质M是 (写化学式,写一个即可,下同),能抑制水电离的物质N是 。25℃时,pH=a的M溶液中水电离出的H+浓度与pH=a的N溶液中水电离出的H+浓度之比为 。
(3)甲、乙、丙分别是B、C、D三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同。回答问题:
①向丙溶液中缓慢滴加过量的乙溶液过程中发生反应的离子方程式
②向甲溶液中缓慢滴加等物质的量的丙溶液后,所得溶液中离子浓度由大到小的顺序为
答案..(1) H C O (每空1分)
(2) Al2(SO4)3 H2SO4或H2SO3或H2CO3(其它合理答案也可) 1014-2a (每空2分)
(3)① 4H+ + AlO2- = Al3+ + 2H2O(1分)Al3+ + 3 AlO2- +6H2O = 4Al(OH)3↓(2分)
②c(Na+)>c(SO42-)>c(HCO3-)>c(OH-)>c(H+)>(CO32-)(3分)
8.(2008-2009学年度江苏省淮阴中学高三第三次调研测试)(10分)A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出,有关产物已略去),其中反应①是置换反应。
(1)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 ;已知l g D与F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式 。
(2)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生, A、D相遇有白烟生成,则形成C的元素原子的电子排布式为 ,反应③的化学方程式是
(3)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,则反应④的化学方程式是
答案..(1)2Fe2++Cl2==2Fe3++2Cl- (2分)
H2(g)+C12(g)==2HCl(g) △H =-184.6kJ/mol(2分)
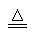 (2)1S22S22P3 (2分) 4NH3+5O2
(2)1S22S22P3 (2分) 4NH3+5O2
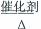 4NO+6H2O (2分)
4NO+6H2O (2分)
(3)C+4HNO3(浓) CO2↑+4NO2 ↑+2H2O (2分)
7.(2008-2009学年度江苏省淮阴中学高三第三次调研测试)下列说法正确的是 ( AD )
A.微粒半径比较: F- > Na+ > Mg2+
B.SO 2和O3同时通入装有湿润的有色布条的集气瓶中,漂白效果一定更好
C.某溶液与淀粉碘化钾溶液反应出现蓝色,则证明该溶液不是氯水就是溴水
D.沸点高低比较为:H2O>HF>CH4
6.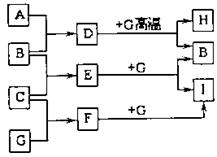 (江苏省南京市2009届高三年级质量检测)(8分)单质A、B、C在常温下均为气态,分别由X、Y、Z三种短周期元素组成;Z元素的原子次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色固体。各物质间的转化关系如右图所示(反应条件多数已略去);
(江苏省南京市2009届高三年级质量检测)(8分)单质A、B、C在常温下均为气态,分别由X、Y、Z三种短周期元素组成;Z元素的原子次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色固体。各物质间的转化关系如右图所示(反应条件多数已略去);
(1)写出D分子的电子式 。
(2)G与D在高温下反应的化学方程式为
。
(3)以石墨为电极电解E的水溶液,其阳
极电极反应式为 。
(4)实验室检验F的水溶液中所含金属阳离
子的操作方法、现象和结论是 。
答案.
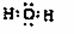
(1)
高温
(2)3Fe+4H2O(g) Fe3O4+4H2
(3)2C1--2e-=C12↑
(4)取少量F的溶液置于一支洁净的试管中,滴入几滴KSCN溶液,观察溶液是否变成红色,如果变红,则证明有Fe3+(其他合理答案均可给分)
4.(江苏省前黄高级中学2008-2009学年第一学期高三期中试卷)若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如下图所示的转化关系,则满足条件的甲和丙可以为[ AC]
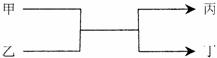
A.钠和氢气 B.氟和氧气 C.碳和硅 D.氯气和溴
5(江苏省南京市2009届高三年级质量检测)下列有关物质性质的比较中,正确的是 ( B )
①热稳定性:CH4>NH3>H2O ②还原性: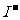 >
>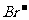 >
>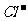
③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>O
A.①③ B.②④ C.①④ D.②③
3.(江苏省安泰高级中学2008-2009高三第一学期期中考试 ) (8分)A、B、C、D、E均为短周期元素且原子序数依次增大,B原子的最外层电子数是内层电子数的3倍,D元素的最高价氧化物的水化物呈酸性,D和B可形成DB2和DB3型化合物,A和E可形成18电子微粒,C元素是地壳中含量最多的金属元素。根据以上
叙述回答下列问题:
(1)E元素在周期表中的位置是 ;
(2)由1 mol气态DB2与B单质反应生成l mol气态DB3,放出98.3 kJ的热量,则由DB2
转化成DB3的热化学方程式是: ;
(3)写出C的阳离子和含C元素的阴离子在水溶液中反应的离子方程式: ;
(4)A2B和A2D比较,沸点高的是(写分子式) ;
答案. (1)第三周期第VIIA族 (2分)
(2) 2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1 (2分)
2SO3(g) △H=-196.6 kJ·mol-1 (2分)
(3)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分) (4) H2O
2.(江苏省栟茶09高三化学测试卷11月)A、B、C、D、E五种元素原子序数逐渐增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是[AD]
A.原子电子层数:A<B B.气态氢化物的稳定性:B<E
C.简单离子半径:E<D D.最高价氧化物对应的水化物碱性:C>D
1.{江苏省赣榆高级中学09高三年级十二月 }(8分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等, A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1) A-F六种元素原子,原子半径最大的是 (填元素符号)。
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为: 。
(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是: 。
(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为: 。
答案.(1)Na(2)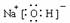 (3)HClO和NH3(NH3·H2O)
(3)HClO和NH3(NH3·H2O)
(4)Cu +2H2SO4(浓)  CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
⒈定义:酸( 、 )与醇发生酯化反应生成的一类有机化合物。
举例:CH3COOC2H5、C2H5ONO2、硝化甘油、油脂(脂肪、油)、涤纶树脂、有机玻璃
苹果、菠萝、香蕉中的香味物质
⒉组成、结构、通式
有机酸酯的结构通式: 官能团:
饱和一元酯:CnH2nO2
|
 ⒊分类:
有机酸酯
⒊分类:
有机酸酯
|
|
 普通酯
普通酯
高级脂肪酸甘油酯--油脂
⒋命名:某酸某酯
写出下列物质的结构简式:
乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯、乙二酸乙二酯
⒌物性:⑴低级酯具有芳香气味,可作香料;
⑵一般是比水 , 溶于水的中性油状液体,可作有机溶剂。
⒍化性:
⑴酯的重要性质:水解反应
① 水解条件:
② 水解方程式:
③与酯化反应的关系:互为可逆反应
RCOOH+HO-R’ RCOOR’+ H2O
RCOOR’+ H2O
思考:分析酯化反应正向和逆向进行的措施。
⑵特殊的酯--甲酸酯:HCOOR
①水解;②氧化反应:能被银氨溶液、新制Cu(OH)2碱性浊液氧化成HOCOOR(碳酸酯)(酯中只有甲酸酯才能发生银镜反应)
试题枚举
[例1]下列说法正确的是( )
A. 酯化反应的实质是酸与醇反应生成水,与中和反应相似
B. 醇与所有酸的反应都是酯化反应
C. 有水生成的醇与酸的反应并非都是酯化反应
D. 两个羟基去掉一分子水的反应就是酯化反应
解析:酯化反应是指酸与醇作用生成酯和水的反应,该反应是分子之间的反应,与中和反应(离子间的反应)有明显的差异性,选项A不正确。无机含氧酸与醇也能发生酯化反应,但无氧酸与醇作用的产物是卤代烃和水,并非酯和水,所以选项B错,C正确。乙醇分子间脱水生成乙醚,也非酯化反应,可见D也错误。
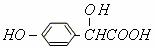 答案:C
答案:C
[例2]有机物A的分子结构为, 写出A实现下列转变所需的药品
(1)A转变为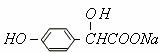 ,
,
(2)A转变为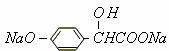 ,
,
(3)A转变为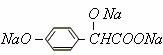 ,
,
解析:A中所含羟基有三类① 酚羟基 ② 醇羟基 ③ 羧基中羟基。三者的酸碱性是不同的,羧基酸性比碳酸强,比无机强酸的酸性弱,酚羟基酸性比碳酸弱,但比碳酸氢根离子酸性强,醇羟基不电离,呈中性。三者与Na、NaOH、Na2CO3、NaHCO3反应情况如下表:
|
|
Na |
NaHCO3 |
Na2CO3 |
NaOH |
|
醇羟基 |
反应 |
不反应 |
不反应 |
不反应 |
|
酚羟基 |
反应 |
不反应 |
反应 |
反应 |
|
羧基 |
反应 |
反应 |
反应 |
反应 |
据此可分析实现不同转化时所需的药品。
答案:(1)NaHCO3 (2)NaOH或Na2CO3 (3)Na
[例3]某中性有机物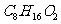 在稀硫酸作用下加热得到M和N两种物质,N经氧化最终可得M,则该中性有机物的结构可能有( )
在稀硫酸作用下加热得到M和N两种物质,N经氧化最终可得M,则该中性有机物的结构可能有( )
A. 1种 B. 2种 C. 3种 D. 4种
解析:中性有机物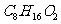 在稀酸作用下可生成两种物质,可见该中性有机物为酯类。由“N经氧化最终可得M”,说明N与M中碳原子数相等,碳架结构相同,且N应为羟基在碳链端位的醇,M则为羧酸,从而推知中性有机物的结构只有
在稀酸作用下可生成两种物质,可见该中性有机物为酯类。由“N经氧化最终可得M”,说明N与M中碳原子数相等,碳架结构相同,且N应为羟基在碳链端位的醇,M则为羧酸,从而推知中性有机物的结构只有
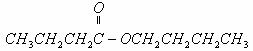 和
和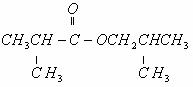 两种。
两种。
答案:见解析
[例4]有一种广泛应用于汽车、家电产品上的高分子涂料,是按下列流程生产的,图中的M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上一氯取代位置有三种。
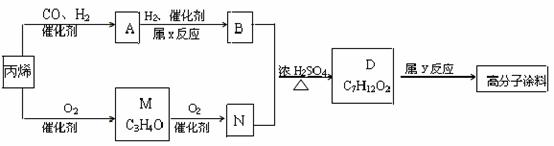
试写出:
(1)物质的结构简式:A ,M ;物质A的同类别的同分异构体为 。
 (2)N+B D的化学方程式
。
(2)N+B D的化学方程式
。
(3)反应类型:x ,y: 。
解析:解本题的关键是M的结构简式的确定。题给条件中M的信息较为丰富:M能发生银镜反应,表明其分子中含有-CHO;又M的化学式为C3H4O,除去-CHO外,其烃基为C2H3-,只可能为CH2=CH-;再加上M是丙烯催化氧化的产物,且还可以继续氧化为N。因此M一定是CH2=CH-CHO,它氧化后的产物N为CH2=CHCOOH。根据D的化学式及生成它的反应条件,B与N生成D的反应只能属于酯化反应;即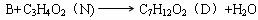 ,由质量守恒定律可推得B的分子式应为:C4H10O,即B为丁醇,故A为丁醛。根据A的烃基上一氯取代物有三种,则A的结构简式为CH3CH2CH2CHO,它的同类物质的同分异构体为:
,由质量守恒定律可推得B的分子式应为:C4H10O,即B为丁醇,故A为丁醛。根据A的烃基上一氯取代物有三种,则A的结构简式为CH3CH2CH2CHO,它的同类物质的同分异构体为: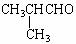 。D的结构简式为:CH2=
。D的结构简式为:CH2=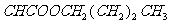 。
。
答案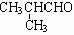 :(1)CH3CH2CH2CHO,CH2=CHCHO,
:(1)CH3CH2CH2CHO,CH2=CHCHO,
(2)
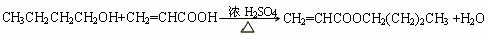
(3)加成反应,加聚反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com