
1.将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应
2A(g)+B(g) 2C(g)
2C(g)
若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·(L·s)-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·(L·s)-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1
其中正确的是( )
A.①③ B.①④ C.②③ D.③④
4.外界条件对化学反应速率影响的适用范围把握不够清楚。
纠错训练
3.思维模糊,混淆了外界条件对化学反应速率的影响和对化学平衡的影响。事实上,温度、压强(对有气体参加和生成的反应)、催化剂这些加快(或减慢)正反应速率的因素,同样也是加快(或减慢)逆反应速率的因素,但加快(或减慢)的幅度可能不同。
2.对同一反应,用不同物质表示的化学反应速率之比等于方程式中各物质的计量数之比,这一规律的运用常出现比例关系的颠倒现象。
1.未注意化学反应速率表示法的要求,对平均速率和瞬时速率不能加以区分;进行有关计算时没有认真分析题给的是什么量,导致运算及单位出错。
10.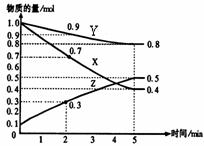 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。(1)由图中的数据分析,该反应的化学方程式为
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。(1)由图中的数据分析,该反应的化学方程式为
;(2)反应开始至2min、5minZ的平均反应速率为 、 ;(3)5min后Z的生成速率比5min末Z的生成速率 (大、小、相等)。
(本题借助于图象考查学生对化学反应速率及表示方法的理解和运用。答题时理清概念、把握规律、注意单位。)
第11课时 化学反应速率(B卷)
易错现象
9.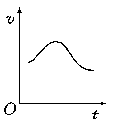 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。
(1)反应开始进行时,反应速率加快的原因是
;
(2)反应后期,反应速率下降的原因是
。
(此题考查学生接受信息的能力、分析和解决问题的能力。答题时要挖掘引起H+浓度增大的原因。)
8.在25℃时,向100mL含HCl14.6g的盐酸溶液中,放入5.6g纯铁粉(若不考虑反应前后溶液体积的变化),反应进行至2min末收集到1.12L(标况)氢气,在此之后又经过4min,铁粉完全溶解。则:
(1)前2min内用氯化亚铁表示的平均反应速率是 (2)后4min内用HCl表示的平均反应速率是
(3)前2min与后4min相比,反应速率较快的是 ,其原因是
。
(本题考查学生对化学反应速率的理解,对化学反应速率表示方法的认识,以及运用化学方程式中各物质的化学计量比的关系进行有关简单计算。答题时要审清题意,注意是用何种物质来表示反应速率的。)
7.增加反应物的浓度、增大压强(有气体参加的反应)、升高温度和使用催化剂都可以增大反应速率。其中能增大反应物分子中活化分子百分数的是 ,
理由是
。
(增大化学反应速率的因素较多,该题要求学生从本质上作出合理的解释。答题时主要考虑活化能的大小对反应速率的影响。)
6.在恒温、恒容的密闭容器中反应A(g) B(g)+C(g);△H<0。若反应物的浓度由2mol/L降到0.8mol/L需20s,那么反应物浓度由0.8mol/L降到0.2mol/L所需时间为( )
B(g)+C(g);△H<0。若反应物的浓度由2mol/L降到0.8mol/L需20s,那么反应物浓度由0.8mol/L降到0.2mol/L所需时间为( )
A.10s B.大于10s C.小于10s D.无法判断
(该题考查浓度对化学反应速率的影响。答题时依据反应速率的定义计算式及反应速率逐渐减慢的特征进行思考.)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com