
12.(9分)实验室需要制备纯净的氯化钾.现有含少量KBr和K2SO4的氯化钾样品,
按照下图所示的实验方案进行提纯.
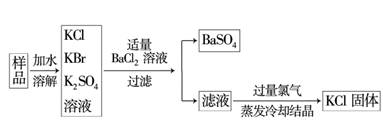
(1)检验加入BaCl2溶液后SO是否沉淀完全的操作为
________________________________________________________________________;
(2)若用硝酸钡来代替氯化钡,请判断是否可行,并说明理由:_
_______________________________________________________________________;
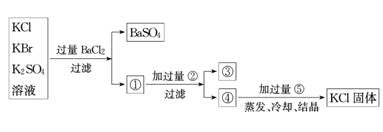
(3)某同学认为该实验方案中加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液
他的思路如下,请写出方框内或横线①②③④⑤中溶质或沉淀(或物质)的化学式:
________________________________________________________________________
________________________________________________________________________.
解析:(1)SO是否沉淀完全,可以证明无SO.
(2)会引入NO即引入KNO3杂质.
答案:(1)静置一段时间后,取少量上层澄清溶液再滴加BaCl2溶液,若无沉淀生成,
说明SO沉淀完全,反之未沉淀完全
(2)不可行,会引入NO
(3)①KCl、KBr、BaCl2;②K2CO3;③BaCO3;④KCl、KBr、K2CO3;⑤HCl和Cl2
11.(12分)可用于分离或提纯物质的方法有:
A.分馏 B.盐析 C.过滤 D.重结晶 E.升华 F.渗析 G.电解 H.加热分解 I.蒸馏 J.灼热氧化
如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题
后空格内:
(1)从石油中分离出汽油和煤油等成分________;
(2)除去淀粉溶液中的少量碘化钠________;
(3)从油脂皂化反应的混合液中分离出高级脂肪酸钠________;
(4)除去粗铜中锌、银等金属________;
(5)除去水中的Na+、SO、Cl-等杂质________;
(6)除去KNO3晶体中混有的少量NaCl________.
解析:(1)汽油和煤油的沸点不同,可用分馏法;
(2)淀粉溶液为胶体不能透过半透膜而NaI可透过半透膜,用渗析法;
(3)分离皂化反应后溶液中的高级脂肪酸钠可用盐析法;
(4)为铜的精炼,可用电解法;
(5)蒸馏法可除去水中的可溶性杂质;
(6)利用KNO3和NaCl溶解度受温度影响不同,可用结晶法.
答案:(1)A (2)F (3)B (4)G (5)I (6)D
10.已知Fe3+的氧化性强于I2,某澄清溶液中可能只含有以下离子中的若干种:Na+、Fe3+、Fe2+、SO、Cl-、Ba2+、I-.现取部分溶液依次进行如下实验:①通入一定量氯气后,加入CCl4振荡,静置后CCl4层呈紫红色,用分液漏斗分液;②向分液后的水溶液中加入足量硝酸酸化的硝酸钡溶液,产生白色沉淀;③过滤后将滤液分为两份,向一份中加入硝酸酸化的硝酸银溶液,产生大量沉淀,向另一份中加入少量KSCN溶液,溶液立即变为红色.根据上述实验,以下推测正确的是 ( )
A.无法确定原溶液中是否存在Cl-、Na+
B.原溶液中肯定存在的离子有Fe3+、SO、I-
C.原溶液一定显中性
D.原溶液中肯定不存在的离子有Fe2+、Ba2+
解析:由实验①可确定溶液中有I-,所以原溶液中无Fe3+.由实验②可知原溶液中含有SO,所以原溶液中无Ba2+.由于实验②中所加入的试剂是硝酸酸化的硝酸钡,因此原溶液中的还原性离子也将被氧化.实验③说明原溶液中含有Fe2+,但不能通过生成的AgCl沉淀确定原溶液中含有Cl-.
答案:A
9.下列各组物质的无色溶液,不用其他试剂即可鉴别的是 ( )
①KOH Na2SO4 AlCl3
②NaHCO3 Ba(OH)2 H2SO4
③HCl NaAlO2 NaHSO4
④Ca(OH)2 Na2CO3 BaCl2
A.①② B.②③
C.①③④ D.①②④
解析:①中Na2SO4与KOH、AlCl3都不反应,而KOH与AlCl3采用一方逐滴加入另
一方中的方法,正滴反滴现象不同.②中Ba(OH)2与NaHCO3、H2SO4都能产生沉淀,
但BaCO3沉淀可与H2SO4反应产生气体,由此可鉴别三者.③HCl、NaHSO4与NaAlO2
反应的现象相同,无法区分开HCl与NaHSO4.④Ca(OH)2与BaCl2不反应,二者与
Na2CO3反应的现象相同,无法区分开Ca(OH)2与BaCl2.
答案:A
8.有A、B、C、D、E、F六瓶不同物质的溶液,它们各是NH3·H2O、Na2CO3、MgSO4、NaHCO3、HNO3和BaCl2溶液中的一种.为了鉴别它们,各取少量溶液进行两两混合,实验结果如表所示.表中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示观察不到明显现象,空格表示实验未做.试推断其中F是 ( )
|
A |
|
||||
|
|
B |
|
|||
|
↓ |
|
C |
|
||
|
↓ |
↓ |
↓ |
D |
|
|
|
↑ |
|
|
|
E |
|
|
|
|
- |
|
|
F |
A.Na2CO3溶液 B.BaCl2溶液
C.MgSO4溶液 D.NaHCO3溶液
解析:本题属于表格型推断题,把两两反应的现象归纳、列表,并和试题信息对照可
得出结论.由表格中A和D与其他物质混合产生的沉淀或气体现象推出D为MgSO4,
A为Na2CO3,进而推出B为NH3·H2O,C为BaCl2,E为HNO3,F为NaHCO3溶液.
答案:D
7.某溶液中含有较大量的Cl-、CO、OH-三种离子,如果只取一次该溶液分别将三种离子检验出来,下列添加试剂顺序正确的是 ( )
A.先加Mg(NO3)2,再加Ba(NO3)2,最后加AgNO3
B.先加Ba(NO3)2,再加AgNO3,最后加Mg(NO3)2
C.先加AgNO3,再加Ba(NO3)2,最后加Mg(NO3)2
D.先加Ba(NO3)2,再加Mg(NO3)2最后加AgNO3
解析:所加试剂只沉淀一种离子,且不影响其他离子.加入Ba(NO3)2时,只沉淀CO,再加入Mg(NO3)2时,只沉淀OH-,最后加入AgNO3时,只沉淀Cl-,故只有D正确.
答案:D
6.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
溴水 |
蒸馏 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
二氧化碳(CO) |
O2 |
点燃 |
|
D |
淀粉(KCl) |
H2O |
置于半透膜袋中漂洗 |
解析:A中加入溴水将NaI转化为I2后,应用CCl4萃取,分液除去碘,A错误.B中加入的氢氧化钠在除去铁离子的同时会与NH反应,且引入钠离子杂质,很难除去,B错误.C中少量杂质CO难以燃烧,且易引入杂质O2,C错误.D中淀粉属于胶体,不能通过半透膜而留在袋中,KCl则可以通过半透膜被洗去,D正确.
答案:D
5.下列实验能达到预期目的的是 ( )
A.检验溶液中是否含有CO:滴加稀盐酸,将产生的气体通入澄清石灰水
B.从含I-的溶液中提取碘:加入适量稀硫酸与3%的H2O2溶液,再用酒精萃取
C.检验蔗糖水解产物:向蔗糖溶液中加入适量稀硫酸水浴加热后,再加入新制的
Cu(OH)2悬浊液,加热至沸腾
D.除去Mg(OH)2中的少量Ca(OH)2:加入足量的MgCl2溶液,充分反应后过滤洗涤
解析:HCO、SO和HSO与盐酸反应产生的气体也能使澄清石灰水变浑浊;酒精与
水互溶,不能萃取水溶液中的物质;加新制的Cu(OH)2悬浊液之前,必须加碱中和溶
液中的酸.
答案:D
4.(2009·广东理基)下列除去杂质的方法正确的是 ( )
A.除去CO2中混有的CO:用澄清石灰水洗气
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
解析:CO2可以被澄清石灰水吸收,而CO不可以,故A项错;盐酸可以将BaCO3反应除去,而不能溶解BaSO4,故B项错;2FeCl3+Fe===3FeCl2,过量的铁过滤,即可除去,故C项对;Cu和CuO均可以被HNO3溶解,故D项错.
答案:C
3.下列实验能达到预期目的的是 ( )
①用蒸馏的方法可将海水淡化 ②将混合气体通过盛有品红溶液的洗气瓶,可除去CO2中的SO2 ③向溶液中滴入盐酸酸化的氯化钡溶液可检验溶液中是否含有SO ④向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,可除去Ca(OH)2
A.①② B.①④
C.②③ D.③④
解析:海水中含有较多的盐分,蒸馏海水由于盐的沸点很高不会蒸出,故①用蒸馏的方法可将海水淡化;二氧化硫与品红溶液反应是可逆的,除不干净,另外二氧化碳也会溶于水,所以要除去二氧化碳中的二氧化硫,应将其通入饱和碳酸氢钠溶液之中;③向溶液中滴入盐酸酸化的氯化钡溶液不能检验溶液中是否含有SO,因为不能排除银离子的干扰;由于氢氧化镁比氢氧化钙难溶,故向含有Mg(OH)2和Ca(OH)2的浊液中加入足量的MgCl2溶液,镁离子会结合氢氧根离子生成Mg(OH)2的沉淀,使Ca(OH)2不断溶解而除去.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com