
7.以下实例中,不属于温度效应的是
A.冬天美洲兔换上白毛
B.4℃以上雪藻死亡
C.快速降温植物受冻害
D.秋天青蛙潜入污泥
6.在北半球植物繁茂的中纬度地区,一年中大气CO2浓度相对较高的季节是
A.春季 B.夏季 C.秋季 D.冬季
5.植物随纬度的增加(从南向北)和海拔高度的增加(从平原到高山)而发生变化的原因之一是
A.当纬度和海拔高度增加时温度会下降
B.阳光照射到山坡的角度较小
C.云总是聚集在山顶上
D.植物比较难于在山坡上定居
4.长期生活在干旱环境中的植物,其形态等方面会出现一系列的适应性特征,下列叙述与干旱环境中植物特征不符的是
A.具有发达的根系
B.具有肥厚的肉质茎
C.具有厚的角质层
D.叶面积增大
3.对于一只生活在田野的蝗虫来说,它的环境是指
A.田野中的植物和蛇、蛙等动物
B.阳光、空气、水分、温度、土壤等非生物因素
C.A与B的总和
D.A与B的总和再加上田野里的其他蝗虫
2.(2002年广东、河南、广西高考题)某一品种的菊花通常在秋季开花,若使其在夏季开花,应当采取的关键措施是在适当时期
A.补充光照使光照时间延长
B.适当提高温度
C.遮光使光照时间缩短
D.适当多浇水
1.(2002年全国高考题)自然界中生物种内及种间是相互作用、相互影响的。下述观点不正确的是
A.林鸽群较大时被苍鹰捕食的几率降低
B.鲈鱼有时捕食鲈鱼的幼鱼,这有利于鲈鱼种的维持
C.自然界中的猴群经过争斗建立了优劣等级制度,并依次占据资源,这对种的保持是有利的
D.自然界中物种间捕食对一个种有利,但会使另一个种消失
14.(14分)碳酸钠与工农业生产、日常生活紧密相关.工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀________(填操作)、洗
涤、烘干、称量.洗涤沉淀的操作是______________________________________
________________________________________________________________________.
方案二:气体分析法
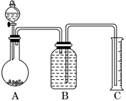
(2)把一定量的样品与足量盐酸反应后,用如图装置测定产生CO2气体的体积,为了测
定结果准确,B中的溶液最好采用________,但选用该溶液后实验结果仍然不够准确,
其原因是_______________________________________________________.
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用如图所示装置,通过称量反应前后盛
有碱石灰的干燥管质量,利用其质量差求算样品的纯度.
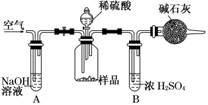
该实验的操作步骤有:①在干燥管内填满碱石灰,质量为m g ②取n g样品装入广口
瓶中 ③检验装置的气密性
④缓慢鼓入空气数分钟,再称量干燥管质量为w g ⑤关闭止水夹 ⑥打开止水夹 ⑦
缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓入空气数分钟
Ⅰ.正确的操作顺序是(填写序号):
③→________→⑥→________→⑤→________→⑦→________→④
Ⅱ.若去掉装置A,测定结果________;若去掉装置B,测定结果________(填“偏大”、
“偏小”或“无影响”).
解析:测定碳酸钠样品(样品中混有氯化钠)中碳酸钠的质量分数,即想法得到一定质量的样品中含有Na2CO3的质量,方法有:设法将Na2CO3或NaCl转化为沉淀或将Na2CO3转化为气体,然后测定沉淀的质量或气体的体积或气体的质量来求算.(1)中沉淀应过滤出来,然后洗涤、干燥、称量.(2)中为保证CO2气体不溶于B瓶液体,瓶中液体应盛饱和NaHCO3溶液以降低CO2的溶解度;但A中所用盐酸具有挥发性,因此CO2气体中会混有HCl,HCl会与NaHCO3溶液作用生成CO2,从而导致CO2的体积要比实际的多.(3)依据实验目的,结合各装置中试剂的性质,不难确定操作顺序等.
答案:(1)过滤 沿玻璃棒缓慢地向过滤器中的沉淀上加蒸馏水至浸没过沉淀物,使水
自然流下,重复2-3次
(2)饱和NaHCO3溶液 CO2气体中混有的HCl气体与NaHCO3溶液作用生成CO2
(3)Ⅰ.② ⑧ ① ⑥ Ⅱ.偏大 偏大
0.2 mol/L(填“大于”或“小于”);若定容不慎超过刻度线,应采用的处理方法是:
________________________________________________________________________.
解析:过滤装置由铁架台(含铁圈)、玻璃棒、漏斗、烧杯、滤纸等组成.本着“除杂不掺杂”的原则,应使杂质变为沉淀或气体或本体物质,故使Ca2+、Mg2+、Fe3+、SO等离子变为沉淀,Ca2+常以碳酸钙形式沉淀,Mg2+可以氢氧化镁或碳酸镁形式沉淀,Fe3+常以氢氧化铁形式沉淀,SO常以硫酸钡形式沉淀,故应先加入BaCl2即可.判断加入BaCl2已过量的方法则应先取少量液体,加入BaCl2或碳酸钠即可.步骤2中,若先用盐酸调节pH再过滤,则会使出现的难溶碳酸盐再溶解,故应过滤后再加盐酸.由图可解答问题(5)缺少玻璃棒引流、容量瓶型号不对.
答案:(1)玻璃棒 漏斗
(2)NaOH→BaCl2→Na2CO3(或BaCl2→NaOH→Na2CO3)
(3)取所得溶液的上层清液1-2滴于滴定板上,再滴入1-2滴BaCl2溶液,若溶液未
变混浊,则表明BaCl2已过量
(4)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
 (5)未用玻璃棒引流;未采用150 mL容量瓶 小于 重新配制
(5)未用玻璃棒引流;未采用150 mL容量瓶 小于 重新配制
13.(15分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质,不符合电解要求,因此必须经过精制.某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸
调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
________________.
(3)步骤2中,判断加入BaCl2已过量的方法是:_______________________________
________________________.
(4)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是
 ________________________________________________________________________.
________________________________________________________________________.
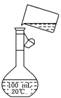
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
同学转
移溶液的示意图,图中的两处错误是:
________________________________________________
________________________________________________.
若在定容时仰视,则所配溶液的浓度_____________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com