
1.官能团的引入
(1)引入C─C:C═C或C≡C与H2加成;(2)引入C═C或C≡C:卤代烃或醇的消去;(3)苯环上引入
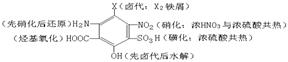
(4)引入─X:①在饱和碳原子上与X2(光照)取代;②不饱和碳原子上与X2或HX加成;③醇羟基与HX取代。(5)引入─OH:①卤代烃水解;②醛或酮加氢还原;③C═C与H2O加成。(6)引入─CHO或酮:①醇的催化氧化;②C≡C与H2O加成。(7)引入─COOH:①醛基氧化;②─CN水化;③羧酸酯水解。(8)引入─COOR:①醇酯由醇与羧酸酯化;②酚酯由酚与羧酸酐取代。(9)引入高分子:①含C═C的单体加聚;②酚与醛缩聚、二元羧酸与二元醇(或羟基酸)酯化缩聚、二元羧酸与二元胺(或氨基酸)酰胺化缩聚。
8.((08山东一模))钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
____________________________________________ 。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•x H2O),反应的化学方程式:
____________________________________________ 。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,
溶液中发生的化合反应的化学方程式______________________________ 。
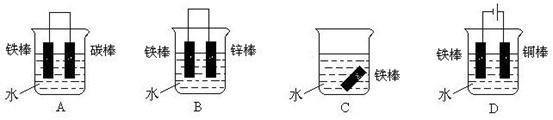
(4)下列哪个装置可防止铁棒被腐蚀_____________ 。
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
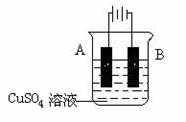
请回答:
① A电极对应的金属是______(写元素名称),B电极的电极反应式是 。
② 若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二
者质量差为5.12 g,则电镀时电路中通过的电子为________________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
答案(1) 
(2)4Fe + 3 O2 + x H2O === 2 Fe2O3•x H2O
(3)2 FeCl3 + Fe == 3 FeCl2
(4)B D
(5)① 铜 Cu2+ + 2e- == Cu
② 0.08 mol
③ 铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀。(其他答案合理也给分)
7.(08山东二模)下列关于工业生产的说法中,不正确的是
A.工业上,用焦炭在电炉中还原二氧化硅得到含少量杂质的粗硅
B.生产普通玻璃的主要原料有石灰石、石英和纯碱
C.工业上将粗铜进行精炼,应将粗铜连接在电源的正极
D.在高炉炼铁的反应中,焦炭为氧化剂
6.(8分)[化学-化学与技术] 聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
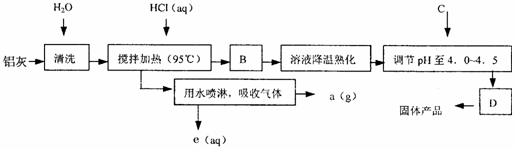
(1)搅拌加热操作过程中发生反应的离子方程式为:
; 。
(2)生产过程中B和D的操作名称分别是 和 (B和D均为简单操作)。
(3)反应中副产品a是 。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
(5)调节pH至4.0~4.5的目的是 。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程C物质可选用 。
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
答案1)Al2O3 + 6H+ = 2Al3+ + 3H2O, 2Al + 6H+ = 2Al3+ + 3H2↑
(2)过滤,过滤 (3)H2 (4)HCl
(5)促进AlCl3水解,使晶体析出 (6)B D
5.(08山东济宁4月模拟)(8分)[化学-化学与技术]
硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有 (任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
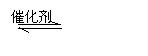
2SO2(g)+O2(g) 2SO3(g) △H=-98.3kJ·mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
。
答案[化学-化学与技术]
(1)硫酸铵(或硫酸钾或过磷酸钙等)(1分)
(2)CD(1分)
(3)99.75%(2分)
(4)SO3 从吸收塔底部进入,吸收剂(浓硫酸)从顶部下淋,形成对流。(2分)

 SO2+NH3+H2O NH4HSO3;2NH4HSO3+H2SO4 (NH4)3SO4+2H2O+2SO2↑
SO2+NH3+H2O NH4HSO3;2NH4HSO3+H2SO4 (NH4)3SO4+2H2O+2SO2↑

 (或SO2+2NH3+H2O (NH4)2SO3;(NH4)2SO3+H2SO4 (NH4)2SO4+H2O+SO2↑)
(或SO2+2NH3+H2O (NH4)2SO3;(NH4)2SO3+H2SO4 (NH4)2SO4+H2O+SO2↑)
(2分)
4.(08聊城二摸)(8分)[化学--化学与技术]
(1)冶金废水含有[Au(CN)2],其电离的CN-有毒,当与H+结合生成HCN时,其毒性更强。工业上处理这种废水是在碱性条件下,用NaC1O将CN-氧化为CO32-和一种元毒气体,该反应的离子方程式为 ,在酸性条件下,C1O-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是
。
(2)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料、反应条件、原料平衡化率和产生等有关信息:
表一:原料、反应条件、平衡转化率、日产量
|
|
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4、100-125℃ |
PdC12-CuC12、100-125℃ |
|
平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
|
日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表二:原料来源于生产工艺
|
|
原料生成工艺过程 |
|
乙炔 |
 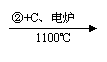 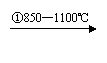 CaCO3 CaO CaC2 C2H2 |
|
乙烯 |
来源于石油裂解 |
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化”的可能原因。
①从产率和产量角度分析 。
②从环境保护和能耗角度分析 。
3.(08青岛质量检测)(8分)[化学-化学与技术]
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
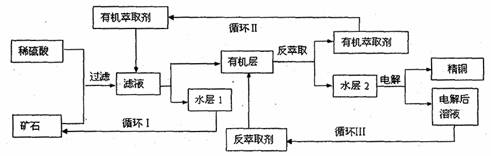
已知:①Cu+在酸性溶液中不稳定,可发生自身氧化还原反应;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中Cu2O发生反应的离子方程式为: ;
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是 。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层1暴露在空气中发生反应的离子方程式 。
(3)写出电解过程中阳极(惰性电极)发生反应的电极反应式: 。
(4)“循环III”中反萃取剂的主要成分是 。
答案.[化学-化学与技术](8分,除化学式1分外,其余每空2分)
(1)Cu2O+2H+=Cu2++Cu+H2O(2分)
(2)FeSO4·7H2O(1分),4Fe2++O2+4H+=4Fe3++2H2O(2分)
(3)4OH--4e-=O2+2H2O(2分)
(4)H2SO4(1分)
31.答案:(1)NH3+H2O+CO2=NH4HCO3(1分)
NH4HCO3+NaCl=NH4Cl+NaHCO3↓(1分)
(2)H2CO3酸性比盐酸弱,CO2与NaCl不反应(1分)
(3)2NH4Cl+CaO=CaCl2+H2O+2NH3↑(1分)
(4)CO2和饱和食盐水 (1分) NH3和CO2(1分)
(5)使NH4Cl析出,可作氮肥,不生成CaCl2,原料NaCl充分利用。(2分)
解析:CO2在水中的反应是可逆反应,因为碳酸是弱酸,所以碳酸氢根离子在水中浓度很小,但是在通入氯气后,氨水也发生可逆反应,因此使得“索尔维法”显得实验难以进行。
2.(08山东高考冲刺预测卷)(8分)[化学--化学与技术]2007年10月是索尔维制碱法命名140周年纪念,1867年在巴黎世界博览会上,将氨碱法正式命名为索尔维制碱法。该法广泛为世界各国采用,后被中国的侯氏制碱法所取代。索尔维法的生产流程是:

索尔维法能实现连续生产,但食盐利用率只有70﹪,且副产品CaCl2没有用途,污染环境。
1940年我国化学家侯德榜先生经过多次实验,冲破了“索尔维法”的技术封锁,并加以改进,食盐利用率达96﹪,得到了纯碱和氯化铵两种产品,被称为“侯氏制碱法”。其基本原理是:
①在30℃-50℃的饱和食盐水中,先通入氨饱和,再通入CO2得碳酸氢钠沉淀。
②过滤,将滤渣加热而得副产品。
③在滤液中加入细食盐末,在10℃-15℃,使NH4Cl沉淀,过滤,滤液为饱和食盐水。
请完成下列问题:
(1)在氨的饱和NaCl溶液中通入CO2的两步反应方程式:
______ ___________。
(2)不能在NaCl溶液中通入CO2制NaHCO3的原因是____________________。
(3)析出小苏打的母液中加入生石灰的反应方程式:_______________。
(4)在“侯氏制碱法”中,_______物质可以循环利用,在“索尔维法”中___________物质可以循环利用。
(5)“侯氏制碱法”与“索尔维”相比,其优点是___________。
1.(08枣庄三诊)[化学--化学与技术]
氨在国民经济中占有重要的地位。现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料。例如,农业上使用的氮肥如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混合肥料和复合肥料,都是以氨为原料制成的;氨氧化法制硝酸是工业上制硝酸的主要方法。
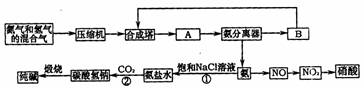 (1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:
(1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:
设备A的名称是 ,设备B的名称是 。
(2)硝酸厂的尾气中含有NO和NO2等污染物,籽了防止污染大气可以用纯碱溶液吸收从吸收塔中放出的尾气,发生的反应如下:Na2CO3+2NO2====NaNO2+NaNO3+CO2
但在实际生的中这种方法处理后尾气中的氮的氧化物含量仍难以降到排放标准,历此,也常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去。写出甲烷与NO2反应的化学反应方程式: 。
(3)常压法生产出的硝酸浓度低,尾气中氮的氧化物含量高,对环境会有严重污染。可采用 法和 法进行改进。
(4)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?为什么 。答案[化学--化学技术]
(1)冷凝器(1分0循环压缩机(1分)
(2)CH4+2NO2==N2+CO2+2H2O(2分)
(3)全压(1分)综合(1分)
(4)不能 因为CO2在水中溶解度较小,顺序颠倒后得不到较高浓度的HCO3-,所以没有NaHCO3生成(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com