
17.实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(下图为Ba(OH)2和Ca(OH)2的溶解度曲线):
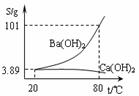
(1)高温灼烧碳酸钡和碳酸钙的混合物,直至分解。所需仪器除坩埚、泥三角、玻璃棒、三脚架外还有 ;
(2)将灼烧后的固体混合物置于80℃的热水中,制成氢氧化钡的热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作是 ;
(3)将“(2)”中滤液 并过滤,得到的Ba(OH)2固体溶于水制成溶液。
(4)向制得的Ba(OH)2溶液中滴加 (填一种试剂名称),再通入二氧化碳。当观察到______ 时,即可停止通二氧化碳。
(5)滤出碳酸钡沉淀,经洗涤、干燥后即得到纯净的碳酸钡。
16.在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
|
序号 |
氢氧化钡的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
8 |
|
② |
22.00 |
18.00 |
7 |
|
③ |
22.00 |
22.00 |
6 |
(1)依据题意判断,t℃___________25℃(填“大于”、“小于”或“等于”),该温度下水的离子积Kw=_____________。
(2)b=____________,原Ba(OH)2的稀溶液的物质的量浓度为_____________。
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达最大量,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为_________,以及其中Na2SO4的物质的量浓度为_________。
15.已知:CH3COOH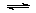 CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=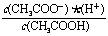 ;CH3COO-+H2O
;CH3COO-+H2O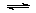
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=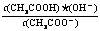 (式中各粒子浓度为平衡时浓度)。
(式中各粒子浓度为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数K、对应离子的水解常数Kh以及水的离子积常数Kw的关系是________________________;由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度___________。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol/L的CH3COOH溶液中c(H+)=____________(不为0);
(3)现用某未知浓度(设为c)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;
②___________________________;
③用________________________(填一种实验方法)测定溶液浓度c。
(4)若测得25℃时CH3COOH的电离平衡常数K=1.8×10-5,则该温度下0.18 mol/L 的CH3COONa溶液的pH=______________。
14.(1)体积相同,浓度均为0.2 mol/L的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为______________。
(2)体积相同,浓度均为0.2mol/L的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为______________。
(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为______________。
(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为______________。
13. (1)标准状况下,用氨气做喷泉实验,实验完毕后,液体进入烧瓶总容积的2/3。假设溶质不外泄,则所得溶液的物质的量浓度为_________。
(2)标准状况下,1体积水可以溶解700体积氨气,所以溶液的密度为0.90 g·mL-1,则所得氨水的物质的量浓度为_________。
(3)某工厂采用硫酸和氢氟酸的溶液作为矿物中稀有元素的萃取液,生产要求该萃取液中硫酸的浓度为3 mol·L-1,氢氟酸的浓度为8 mol·L-1。现有一批回收酸液共400 L,经测定其中氢氟酸浓度为12 mol·L-1, 硫酸的浓度为1 mol·L-1。现要用此回收酸液配制上述萃取液,400 L回收酸液经稀释可以得到_______L 8 mol·L-1氢氟酸。在400 L 回收酸液中加入_________ L密度为1.84 g·cm-3、浓度为98%的浓硫酸,然后_______,即可得到符合要求的萃取液。
12.在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶2 D.1∶4
11.质量分数为a%的KOH 溶液,蒸发掉63g水,质量分数恰好增大一倍,体积变为500mL,则浓缩后溶液的物质的量溶液为
A.2mol·L-1 B.4mol·L-1 C.5mol·L-1 D.0.63mol·L-1
10.下表为四种溶液的溶质的质量分数和物质的量浓度的数值
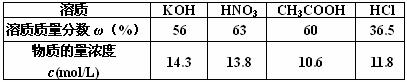
根据表中数据判断上述四种溶液中的密度最小的是
A.HCl B.HNO3 C.CH3COOH D.NaOH
8. 常温下,下列溶液中由水电离出来的
c(H+)=1×10-9mol/L的是
A.pH=5的NH4Cl溶液 B.pH=9的Na2CO3溶液
C.pH=7的CH3COONa溶液 D.pH=5的KHSO4溶液9. 下列说法正确的是
A.把100mL3mol·L-1的H2SO4跟100mLH2O混合,硫酸的物质的量浓度改变为1.5mol·L-1
B.把100g20%的NaCl溶液跟100gH2O混合后,NaCl溶液的质量分数是10%
C.把200mL3mol·L-1的BaCl2溶液跟100mL3mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol·L-1
D.把100mL20%的NaOH溶液跟100mLH2O混合后,NaOH溶液的质量分数是10%
7. 实验室里需用480mL0.1mol·L-1的硫酸铜溶液,现选用500mL容量瓶进行配制,以下操作正确的是
A.称取7.68g硫酸铜,加入500mL水
B.称取12.0g胆矾配制成500mL溶液
C.称取8.0g硫酸铜,加入500mL水
D.称取12.5g胆矾配制成500mL 溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com