
5.[命题意图]考查学生对影响化学反应速率的外界因素(如浓度、温度)及其规律的认识和理解;考查学生对图表的观察、分析以及处理实验数据归纳出合理结论的能力。
[答案](1)研究反应物I-与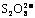 的浓度对反应速率的影响。
(2)29.3 s。 (3)A。
的浓度对反应速率的影响。
(2)29.3 s。 (3)A。
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)。
7.(2007年高考广东化学卷,新课标-化学平衡)(10分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到重要的化工原料,反应的化学方程式为________________________________________________________________________。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是__________________________________________________。
1-4:B、D、A、BD
6.(2007年高考海南化学卷,反应速率)(9分)下表是稀硫酸与某金属反应的实验数据:
|
实验 序号 |
金属质量 /g |
金属 状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失 的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,________________________ 对反应速率有影响,________________反应速率越快,能表明同一规律的实验还有_________(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有_____________(填实验序号);
(3)本实验中影响反应速率的其他因素还有_______________,其实验序号是___________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:______________________________________________________________________________。
5.(2007年高考广东化学卷,化学速率) (8分)“碘钟”实验中,3I-+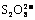 =I3- +2SO42 -的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
=I3- +2SO42 -的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/ mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
c(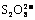 )/mol·L-1 )/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是___________________________________________________。
(2)显色时间t1=______________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)。
(A)<22.0 s (B)22.0 s-44.0 s (C)>44.0 s (D)数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________________________。
4. (2007年高考江苏卷,化学平衡)一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )
2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )
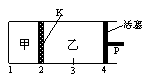



图1 图2 图3
(A)保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
(B)保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
(C)保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
(D)保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
20.(A)16.7% (B)0% (C)80.0% (D)83.3%
3.(高考理综宁夏卷,化学平衡计算)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是( )
2.(高考理综天津卷,6分,化学平衡-合成氨)下列有关工业生产的叙述正确的是( )
(A)合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
(B)硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
(C)电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
(D)电解精炼铜时,同一时间内阳极溶液铜的质量比阴极析出铜的质量小
1.(2007年高考理综四川卷,化学平衡-平衡移动)向某密闭容器中充入1 mol CO和2
mol H2O(g),发生反应:CO+H2O(g) CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,超始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,超始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
(A)0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
(B)1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
(C)0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
(D)0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
4.讨论:条件选择SO2(g)+ O2(g)  SO3(g);△H = -98.3kJ/mol结合SO2接触氧化反应特点,我们应选择怎样的生产条件?
SO3(g);△H = -98.3kJ/mol结合SO2接触氧化反应特点,我们应选择怎样的生产条件?
|
|
压强 |
温度 |
催化剂 |
|
反应速率问题(为了增大速率) |
|
|
|
|
化学平衡问题(为了提高转化率) |
|
|
|
|
实际生产过程中的条件 |
|
|
|
附工业制硫酸流程图:
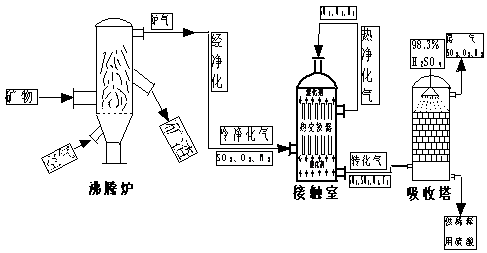
07年高考试题选编
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com