
3、极限法
也称极值法、极端假设法,就是通过找出两个极端特征点(一是假设某反应物完全反应时,二是假设某反应物完全不反应时),来进行有关的计算和判断。
例3(2005年绍兴试题)某密闭容器中进行如下反应:X(g) +2Y(g)2Z(g),若要使平衡时反应物总的物质的量与生成物的总物质的量相等,则X、Y的初始物质的量之比应满足( )
0.8mol0.8mol 0.4mol0.4mol
2、 差量法
依据可逆反应中各物质的初态终态体积、物质的量或压强的变化进行计算。差量法在解此类题中是一种常用的方法。
例2(2005年广州试题)某温度下,在定容密闭容器中发生如下反应: 2A(g)2B(g)+ C(g), 若开始时只充入2molA气体, 达平衡时, 混合气体的压强比起始时增大了20%, 则平衡时A的体积分数为()
A.60% B.50% C.70% D.40%
[解析]在定容的情况下,气体的压强与物质的量成正比,因此气体的物质的量增多了2mol>20%=0.4 mol。
2A(g)2B(g)+C(g)>n
1、平衡“三段式”法
根据可逆反应方程式,列出反应物、产物各物质的初始量、变化量、平衡量,然后依据已知条件建立方程式而求解的一种方法。此方法是解决化学平衡计算问题的基本方法。
例1 在一定温度下,将100mol N2、H2的混合气体充入密闭的恒压容器中反应,达平衡时,测得混合气体的密度是反应前密度的1.25倍,平均式量为15.5,则平衡时,N2转化的百分率为( )
A.20% B.25% C.30% D.40%
[解析]设反应掉N2物质的量为x,起始N2物质的量为a,H2物质的量为b依题意:
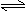
 N2 + 3H2
2 NH3
N2 + 3H2
2 NH3
起始: a b 0
转化: x 3x 2x
平衡: a-x b-3x 2x a+b=100a+b=1.25a+b-2x28a+2b=15.5a+b-2x 解之得:x=10mola=40molb=60mol
 4X(气) + 3Y(气) 2Q(气) + nR(气) △n
4X(气) + 3Y(气) 2Q(气) + nR(气) △n
4 3 2 n ( 2+n )-( 4+3) = n-5
3×1/3 5×5%
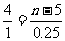 所以 n = 6
所以 n = 6
此法较方法一简单,但仍需要计算,与方法一无质的飞跃。方法三:看出该反应在温度、体积不变条件下进行,达平衡时压强增大5%,则必为体积增大的反应,则反应方程式右边系数和必比左边大,所以 n = 6。此法能力层次高,敏锐地抓住系统压强增大与反应方程式本身特点(系数大小)的关系,对平衡移动原理的理解较为深入,又如许多高考试题只有破除常规解法,打破思维定势,才能找到简捷的解题途径。
[例2] 在一定温度下,把2mol SO2 和1mol O2 通入一个密闭容器里发生如下反应:
催化剂
 2SO2 + O2
2SO3
2SO2 + O2
2SO3
当此反应进行到一定程度时,反应混合物处于化学平衡状态,现在该容器中维持温度不变,令 a , b , c 取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
(1) 若 a = 0 ,b = 0,则 C = __________;
(2) 若 a = 0.5,则 b = ________, 和C = ________;
(3) a , b , c 取值必须满足的一般条件是(请用两个方程式表示,其中一个只含有 a 和c ,另一个只含 b 和c )_________;_________。
[分析]:本题是一个难度较大的题目。若从化学平衡常规解法入手求解,繁琐耗时多;若运用质量守恒定律可大大简化解题过程。
根据初始状态和平衡状态的原子守恒:
由硫原子守恒,可得:a + c = 2 ①
由氧原子守恒,可得:2a + 2b +3c = 2×2+2×1=6 ②
由上式 ①② 即可求解。
解:(1) 若 a = 0 , b = 0, 则 c = 2 ( mol )
(2) 若 a = 0.5mol, 则 b = 0.25, c = 1.5mol
(3) 由 a + c = 2,得 a = 2-c 。代入式②得 2b + c = 2,类似的情形还很多。这样学生认识到,基础理解有多深,解题有多快。由此极大地刺激了学生钻研基础的兴趣,形成了良好的讨论研究的气氛,学和思路开阔,提高了触类旁通,灵活应变的能力。
总之,教师在教学过程中和学生的学习过程中必须重视基础,适当提高,循序渐进,以能力提高为目标提高效率,促进学生能力和综合素质的提高。以上是本人在教学过程中的初浅经验和尝试,祈望同仁不吝赐教。
4.由阿佛加德罗定律推论得出:
等温等压:气体体积比等于其物质的量比。
等温等容:气体的压强比等于其物质的量比。
 例如:在一个固定体积的密闭容器中,放入3升X(气)和2升Y(气),在一定条件下发生下列反应:4X(气) + 3Y(气) 2Q(气) + nR(气)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减少1/3,则该反应式中的n 值是:
例如:在一个固定体积的密闭容器中,放入3升X(气)和2升Y(气),在一定条件下发生下列反应:4X(气) + 3Y(气) 2Q(气) + nR(气)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减少1/3,则该反应式中的n 值是:
(A) 3 (B) 4 (C) 5 (D) 6
[分析] 题内已知条件可知:X的浓度减小时压强增大,即可推断出该反应为分子数增大的反应,根据阿佛加德罗定律,将体积转化为物质的量,按常规解法求解。
方法一:
 4X(气) + 3Y(气) 2Q(气)
+ nR(气)
4X(气) + 3Y(气) 2Q(气)
+ nR(气)
起始物质的量 3 2 0 0
转化物质的量 3×1/3 3/4 1/2 n/4
平衡物质的量 2 5/4 1/2 n/4
在恒温恒容时,压强比等于物质的量比
P始 n始 1 5
-- = -- ---- = --------
P平 n平 (1 +0.05 ) ( 2+5/4+1/2+n/4 )
所以 n = 6
这类题型很多,在此不再例举,这种常规解法是解化学平衡计算题的万能钥匙,但这方法有一缺点对于某些高考试题解起来繁琐耗时,必须通过巧解,那怎样形成这样的思维呢?
3.上述关系中的浓度也可用起始物质的量转化的物质的量、平衡物质的量代替
对于某一可逆反应:
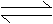 Ma + nB
pC + qD
Ma + nB
pC + qD
超始浓度 ( mol/L ) a b c d
转化浓度 ( mol/L ) mx nx px qx
平衡浓度 ( mol/L ) a―mx b―nx c+px d+qx
该物质的转化浓度
某物质的转化率 = ---------- ×100%
该物质的起始浓度
说明:1. 上述3种浓度中,只有转化浓度之比等于方程式的系数比。
2.反应物的平衡浓度 = 起始浓度 - 转化浓度
生成物的平衡浓度 = 起始浓度 + 转化浓度
7.[命题意图]考查学生对化学反应可逆性、化学平衡、化学平衡常数和影响化学平衡的外界条件的了解;考查学生对盐类的水解、常见非金属元素硫及其重要化合物的主要性质及其对环境质量影响的了解;考查学生计算平衡常数和平衡转化率的能力以及学生对化学平衡和元素化合物知识的综合应用及知识迁移能力。
(2)B、C。 (3)SO2+H2O+Na2SO3=2NaHSO3。
(4)抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+。
6.[答案](1)固体反应物的表面积; 表面积越大; 1和2(或4和5)。 (2)1、3、4、6、8;或2和5。 (3)反应温度; 6和7,8和9。 (4)可能是硫酸过量,金属全反应,放出的热量相等,所以使等体积溶液的温度升高值相近。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com