
2.甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种。将它们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀;②丙与乙或丁混合也产生沉淀;③丁与乙混合产生无色气体。回答下面问题:
(1) 写出丁与乙反应的离子方程式:
。
(2)这四种溶液分别是甲: 。乙: 、丙: 、丁: 。
(此题考查碳酸钠等物质的性质及综合运用能力)
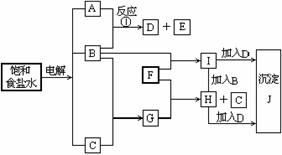 3(94年高考题).下图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去).
3(94年高考题).下图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去).
请填写下列空白:
(1)物质B是 ,F是 ,J是 .
(2)反应①的离子方程式是
(此题为无机框图题,主要考查电解饱和食盐水的知识,氢氧化钠、氯气、氢气等性质的灵活运用能力。)
新活题网站
1.在一定温度下,向足量的饱和Na2CO3溶液中加入1.06克无水Na2CO3,搅拌后静置,最终所得晶体的质量 ( )
A.等于1.06克 B.大于1.06克而小于2.86克
C.等于2.86克 D.大于2.86克
(此题考查含结晶水的化合物的溶解度的计算。)
4. 碳酸钠和碳酸氢钠
碳酸钠俗名纯碱或苏打,是白色粉末。碳酸钠晶体(Na2CO3·10H2O)在空气里易风化而失去结晶水。碳酸氢钠俗名小苏打,是细小的白色晶体。碳酸钠比碳酸氢钠容易溶解于水。
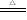 碳酸钠比碳酸氢钠稳定,碳酸钠加热不分解,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水。
碳酸钠比碳酸氢钠稳定,碳酸钠加热不分解,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水。
2NaHCO3 Na2CO3 + H2O + CO2↑ 实验室常利用这个反应鉴别碳酸钠比碳酸氢钠。
碳酸钠比碳酸氢钠都能和盐酸反应生成氯化钠、二氧化碳和水。
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
碳酸氢钠与盐酸反应剧烈。
典型题点击
3. 氢氧化钠
氢氧化钠是白色固体,极易溶于水,溶解时放出大量的热。暴露在空气中易潮解。可做某些气体的干燥剂。俗称苛性钠、火碱或烧碱。氢氧化钠是实验室里及工业上常用的碱。具有碱的通性。
2. 过氧化钠和氧化钠
过氧化钠是淡黄色的固体,氧化钠是白色固体。过氧化钠能与水反应生成氢氧化钠和氧气,
2Na2O2 + 2H2O = 4NaOH + O2↑
与二氧化碳反应生成碳酸钠和氧气。
2Na2O2 + CO2 = 2Na2CO3 + O2↑
过氧化钠是强氧化剂,属于过氧化物。氧化钠属于碱性氧化物,具有碱性氧化物的性质。
1. 钠
(1)钠的物理性质 钠是有银白色金属光泽的固体,很软,熔点低,密度比水小,是热和电的良导体。
(2)钠的化学性质 钠最外层上只有1个电子,在反应中很容易失去。因此,钠的化学性质很活泼,能与氧气等许多非金属及水起反应。
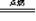 钠与氧气等非金属反应,钠在空气中缓慢氧化生成白色的氧化钠,在空气中燃烧生成过氧化钠。
钠与氧气等非金属反应,钠在空气中缓慢氧化生成白色的氧化钠,在空气中燃烧生成过氧化钠。
2Na + O2 Na2O2
钠与水反应生成氢氧化钠和氢气。
2Na + 2H2O = 2NaOH + H2↑ 所以实验室里钠保存在煤油里。
13.(1)①
②
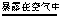 ③4Na+O2
2Na2O
③4Na+O2
2Na2O
(2)0; -1; -2,
(3)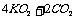 ==?2K2CO3+3O2
==?2K2CO3+3O2
④ 略
12.通入CO2的物质的量=
溶液中NaOH物质的量=1.00L×1.00mol·L-1=1.00mol
根据2NaOH+CO2=Na2CO3+H2O
2 : 1
该反应中CO2过量0.750mol-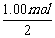 =0.250mol
=0.250mol
Na2CO3+CO2+H2O=2NaHCO3
1 : 1 : 2
反应中NaCO3过量,生成的NaHCO3为n(反应CO2)×2=0.500mol (1分)
溶液中剩余的Na2CO3为0.500mol-0.250mol=0.250mol
11.(1)84:︰100 (2)5a/46
(3)22.4a/92或5.6a/23
(4)盐酸的物质的量浓度
(5)(22.4/100) a~(22.4/84)a
10. (1)除去吸人空气中的CO2
(2) D(3)可增大气体与溶液的接触面积,使气体中的CO2被充分吸收
(4)[(ag/44g·mol-1)×22.4L·mol-1]/[bL+(ag/44g.mol-1×22.4L·mol-1)]
(5)把瓶1中的NaOH溶液吸人口中;把瓶II中的NaOH溶液吹出瓶外。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com