
[例1] 下列叙述正确的是
A.P4和NO2都是共价化合物
B.CCl4和NH3都是以极性键结合的极性分子
C.在CaO和SiO2 晶体中,都不存在单个小分子
D.甲烷的结构式: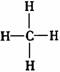 是对称的平面结构,所以是非极性分子
是对称的平面结构,所以是非极性分子
[解析] P4和NO2分子中都含有共价键,但P4是单质,故选项A错误。CCl4是含有极性键的非极性分子,故选项B错误。原子晶体、离子晶体和金属晶体中不存在小分子,只有分子晶体中才存在小分子,故选项C正确。甲烷分子为正四面体形的非极性分子,故选项D错误。本题正确答案为C。
[例2] 关于化学键的下列叙述中,正确的是
A.离子化合物可能含共价键 B.共价化合物可能含离子键
C.离子化合物中含离子键 D.共价化合物中不含离子键
[解析] 凡含有离子键的化合物不管是否含有共价键,一定属于离子化合物,所以共价化合物中不可能含有离子键。本题正确答案为ACD。
3.“相似相溶”规律
极性分子组成的溶质易溶于由极性分子组成的溶剂;非极性分子组成的溶质易溶于由非极性分子组成的溶剂。
思维技巧点拨
2.物质溶沸点的比较
(1)不同类晶体:一般情况下,原子晶体>离子晶体>分子晶体
(2)同种类型晶体:构成晶体质点间的作用大,则熔沸点高,反之则小。
①离子晶体:离子所带的电荷数越高,离子半径越小,则其熔沸点就越高。
②分子晶体:对于同类分子晶体,式量越大,则熔沸点越高。
③原子晶体:键长越小、键能越大,则熔沸点越高。
(3)常温常压下状态
①熔点:固态物质>液态物质
②沸点:液态物质>气态物质
1.分类
表4-6各种晶体类型的比较
|
|
离子晶体 |
原子晶体 |
分子晶体 |
金属晶体 |
|
存在微粒 |
阴阳离子 |
原子 |
分子 |
金属离子、自由电子 |
|
微粒间作用 |
离子键 |
共价键 |
范德华力 |
金属键 |
|
主要性质 |
硬而脆,易溶于极性溶剂,熔化时能够导电,溶沸点高 |
质地硬,不溶于大多数溶剂,导电性差,熔沸点很高 |
硬度小,水溶液能够导电,溶沸点低 |
金属光泽,是电和热的良导体,熔沸点高或低 |
|
实例 |
食盐晶体 |
金刚石 |
氨、氯化氢 |
镁、铝 |
3.分子极性的判断
(1)只含有非极性键的单质分子是非极性分子。
(2)含有极性键的双原子化合物分子都是极性分子。
(3)含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的为极性分子。
注意:判断ABn型分子可参考使用以下经验规律:①若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,若不等则为极性分子;②若中心原子有孤对电子(未参与成键的电子对)则为极性分子,若无孤对电子则为非极性分子。
2.常见分子的类型与形状
表4-5常见分子的类型与形状比较
|
分子类型 |
分子形状 |
键角 |
键的极性 |
分子极性 |
代表物 |
|
A |
球形 |
|
|
非极性 |
He、Ne |
|
A2 |
直线形 |
|
非极性 |
非极性 |
H2、O2 |
|
AB |
直线形 |
|
极性 |
极性 |
HCl、NO |
|
ABA |
直线形 |
180° |
极性 |
非极性 |
CO2、CS2 |
|
ABA |
角形 |
≠180° |
极性 |
极性 |
H2O、SO2 |
|
A4 |
正四面体形 |
60° |
非极性 |
非极性 |
P4 |
|
AB3 |
平面三角形 |
120° |
极性 |
非极性 |
BF3、SO3 |
|
AB3 |
三角锥形 |
≠120° |
极性 |
极性 |
NH3、NCl3 |
|
AB4 |
正四面体形 |
109°28′ |
极性 |
非极性 |
CH4、CCl4 |
|
AB3C |
四面体形 |
≠109°28′ |
极性 |
极性 |
CH3Cl、CHCl3 |
|
AB2C2 |
四面体形 |
≠109°28′ |
极性 |
极性 |
CH2Cl2 |
1.非极性分子和极性分子
表4-4 非极性分子和极性分子的比较
|
|
非极性分子 |
极性分子 |
|
形成原因 |
整个分子的电荷分布均匀,对称 |
整个分子的电荷分布不均匀、不对称 |
|
存在的共价键 |
非极性键或极性键 |
极性键 |
|
分子内原子排列 |
对称 |
不对称 |
表4-3非极性键和极性键的比较
|
|
非极性键 |
极性键 |
|
概念 |
同种元素原子形成的共价键 |
不同种元素原子形成的共价键,共用电子对发生偏移 |
|
原子吸引电子能力 |
相同 |
不同 |
|
共用电子对 |
不偏向任何一方 |
偏向吸引电子能力强的原子 |
|
成键原子电性 |
电中性 |
显电性 |
|
形成条件 |
由同种非金属元素组成 |
由不同种非金属元素组成 |
表4-2离子键、共价键和金属键的比较
|
化学键类型 |
离子键 |
共价键 |
金属键 |
|
概念 |
阴、阳离子间通过静电作用所形成的化学键 |
原子间通过共用电子对所形成的化学键 |
金属阳离子与自由电子通过相互作用而形成的化学键 |
|
成键微粒 |
阴阳离子 |
原子 |
金属阳离子和自由电子 |
|
成键性质 |
静电作用 |
共用电子对 |
电性作用 |
|
形成条件 |
活泼金属与活泼的非金属元素 |
非金属与非金属元素 |
金属内部 |
|
实例 |
NaCl、MgO |
HCl、H2SO4 |
Fe、Mg |
表4-1化学键与分子间作用力的比较
|
|
化学键 |
分子间作用力 |
|
概念 |
相邻的原子间强烈的相互作用叫化学键 |
把分子聚集在一起的作用力,叫做分子间作用力,又称范德华力 |
|
作用范围 |
分子或晶体内 |
分子之间 |
|
作用力强弱 |
较强 |
与化学键相比弱得多 |
|
影响的性质 |
主要影响化学性质 |
主要影响物理性质(如熔沸点) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com