
8.N-H键能的含义是( )
A.由N和H形成1 mol NH3所放出的热量
B.把1 mol NH3的键全部拆开所吸收的热量
C.拆开6.02×1023个N-H键所吸收的能量
D.形成1个N-H键所放出的热量
7.下列叙述正确的是( )
A.两种元素构成的共价化合物分子中的化学键都是极性键
B.含有非极性键的化合物不一定是共价化合物
C.只要是离子化合物,其熔点就一定比共价化合物的熔点高
D.只要含有金属阳离子,则此物质中必定存在阴离子
6.下列电子式中,正确的是( )


5.已知磷酸分子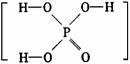 中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是( )
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是( )

4.下列分子的结构中,原子的最外层不能都满足8电子稳定结构的是( )
A.CO2 B.PCl3 C.CCl4 D.NO2
3.溴化碘(IBr)的化学性质似卤素单质,能跟大多数金属反应生成金属卤化物,能跟某些非金属单质反应生成相应卤化物,能跟水反应,其化学方程为IBr+H2O HBr+HIO,下列有关IBr的叙述中,正确的是( )
HBr+HIO,下列有关IBr的叙述中,正确的是( )
A.固体IBr是分子晶体
B.在很多反应中IBr是强氧化剂
C.IBr跟水反应时,它既是氧化剂又是还原剂
D.跟NaOH溶液反应生成NaBr和NaIO
2.实现下列变化时,需克服相同类型作用力的是( )
A.二氧化硅和干冰的熔化 B.液溴和液汞的气化
C.食盐和冰的熔化 D.纯碱和烧碱的熔化
1.下列物质的化学式中,具有非极性键的离子化合物是( )
A.Na2O B.MgF2 C.NaOH D.Na2O2
[例4] 图4-1是石英晶体平面示意图,它实际上是立体的网状结构,其中硅、氧原子数之比为_______。原硅酸根离子SiO44-的结构如图4-2所示,二聚硅酸根离子Si2O76-中,只有硅氧键,它的结构可表示为_______。


[解析] 由图4-1可以看出:每个硅原子周围结合4个氧原子,同时每个氧原子跟2个硅原子结合,因此二氧化硅晶体(石英)是由氧、硅原子按原子个数1∶2组成的立体空间网状结构的原子晶体。Si2O76-只有硅氧键,根据SiO44-的结构图可得Si2O76-的结构图见图4-3。
[例5] (1)中学化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图4-4所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。

[解析] 晶胞中阴、阳离子个数的确定通常采用“原子分割法”,具体如下:①处于顶点的离子,同时为8个晶胞共有,每个离子有1/8属于晶胞;②处于棱上的离子,同时为4个晶胞共有,每个离子有1/4属于晶胞;③处于面上的离子,同时为2个晶胞共有,每个离子有1/2属于晶胞;④处于内部的1个离子,则完全属于该晶胞,该离子数目为1。要确定NiO的密度,就应确定单位体积中NiO分子的个数,再结合NiO的摩尔质量求算出该晶体中NiO的质量,最后求出密度。本题解答如下:
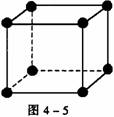
(1)如图4-5所示,以立方体作为计算单元,此结构中含有Ni2+-O2-离子数为:4×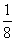 =
=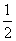 (个),所以1 mol NiO晶体中应含有此结构的数目为6.02×1023÷
(个),所以1 mol NiO晶体中应含有此结构的数目为6.02×1023÷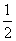 =12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1 mol NiO的体积应为12.04×1023×(a×10-8)cm3,NiO的摩尔质量为74.7g/mol,所以NiO晶体的密度为
=12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1 mol NiO的体积应为12.04×1023×(a×10-8)cm3,NiO的摩尔质量为74.7g/mol,所以NiO晶体的密度为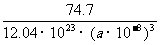 =
= (g/cm3)
(g/cm3)
(2)解法一(列方程):设1 mol Ni0.97O中含Ni3+为 x mol,Ni2+为y mol,则得

解得x=0.06,y=0.91,故n(Ni3+)∶n(Ni2+)=6∶91
解法二(十字交叉):由化学式Ni0.97O求出Ni的平均化合价为2/0.97,则有

故n(Ni3+)∶n(Ni2+)=6∶91。
 |
|
|
本周强化练习: |
|
|
|
能力突破训练
[例3] 碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是
A.①③② B.②③① C.③①② D.②①③
[解析] 由于题给的三种物质都属于原子晶体,而且结构相似都是正四面体形的空间网状结构,所以晶体的熔点由微粒间的共价键强弱决定,这里共价键强弱主要由键长决定,可近似地看作是成键原子的半径之和,由于硅的原子半径大于碳原子,所以键的强弱顺序为C-C>C-Si>Si-Si,熔点由高到低的顺序为金刚石>碳化硅>晶体硅。本题正确答案为A。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com