
36.某电解质溶液中可能存在的离子为:Ag+、H+、Cu2+、CO32-、OHˉ、Clˉ你认为可以肯定存在的离子有: Cl- ,肯定没有的离子是: Ag+、CO32-、OHˉ,还需进一步确认的离子有: H+、Cu2+ 确认的实验方法是: 观察溶液颜色,如有蓝色则有Cu2+;加入铁粉,如有气泡产生,则有H+ 。
37. 根据下图所示转化顺序及实验现象回答问题。已知D、G焰色反应为紫色(隔蓝色钴玻璃),A、E含有同种阴离子。C、F为同主族单质,其它与反应无关的物质已略去。
33.测定水中溶解氧气的方法是:取a mol水样,迅速加入MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子、振荡,使反应充分;开塞,迅速加入适量H2SO4,此时有I2生成;用Na2S2O3溶液(浓度b mol?L-1)和I2反应,消耗了V mL达到终点(以淀粉作指示剂)。有关方程式为:①2Mn2++O2+4OH-===2MnO(OH)2(反应很快)
―15―
②MnO(OH)2+2I-+4H+===Mn2++I2+3H2O
③I2+2S2O32―===S4O62―+2I-
⑴需要进行滴定的反应是: ③ ,终点的颜色变化为: 蓝色褪去 。
⑵水中溶解O2为(以mg/L为单位): (8bv/a)×103 mg/L。
⑶加MnSO4及含NaOH的KI溶液振荡时,塞子若未塞紧(设未溅出溶液),测得结果将 偏高 (填“偏高”“偏低”或“无影响”),原因是: 外界空气中O2进入,氧化Mn2+ 。
34. 已知HCO3-比HBrO更难电离,但HBrO的酸性弱于H2CO3。写出下列反应的离子方程式:⑴向小苏打溶液中滴加少量溴水: HCO3-+Br2==HBrO+Br-+CO2↑ ;
⑵向苏打溶液中滴加少量溴水: 2CO32-+Br2+H2O==2HCO3-+Br-+BrO- 。
35. 我们知道空气中含有N2、O2、CO2、H2S等气体。分析下列现象的原因,并写出有关离子方程式。
⑴以酚酞为指示剂,用碱液滴定酸液到显现浅红色在半分钟内不褪色为终点。约半分钟后导致褪色的原因: 空气中存在CO2,H2S:CO2+OH-==HCO3-,H2S+OH-==HS-+H2O 。
⑵以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32-+I2===S4O62-+2I-),到蓝色恰好褪去为终点,约半分钟后溶液又显蓝色的原因是:___空气中存在O2: O2+4I-+4H+===2H2O+I2 。
⑶以紫色KMnO4为标准溶液滴定还原剂,在消耗完还原剂后,再多加0.5―1滴KMnO4溶液后呈现的浅红色在半分钟内不褪色为终点。约半分钟后浅红色褪色的可能原因:_空气中可能存在H2S等还原性气体:5H2S十2MnO4-+6H+==2Mn2++5S↓+8H2O 。
_
Mg2++2HCO3―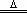 Mg(OH)2↓+2CO2↑。
Mg(OH)2↓+2CO2↑。
_ HCO3―+H2O H2CO3+OH-。
H2CO3+OH-。
⑵充分加热⑴步所得的溶液,加热的过程中观察到的现象有: 放出气体,溶液变浑浊,红色加深 ;完全反应后,溶液呈 红 色,有关反应的离子方程式为:
32.在含有Na+、Mg2+、HCO3―、SO42―的稀溶液中,它们的物质的量之比为2:1:2:1。
⑴向该溶液中滴加酚酞试液数滴,溶液呈淡粉红色,有关反应的离子方程式为:
⑴ Al3++3OH-====Al(OH)3↓ ; ⑵ NH4++OH-
⑵ NH4++OH- NH3?H2O;
NH3?H2O;
⑶NH3?H2O NH3↑+H2O; ⑷ Al(OH)3+OH-====AlO2-+2H2O 。
31.铝铵矾[NH4Al(SO4)2?12H2O]是一种重要的工业原料,将它溶于水配成溶液,然后逐滴滴入NaOH(aq),已知:NH4++AlO2-+H2O====Al(OH)3↓+NH3↑,写出先后发生反应的离子方程式:
Ca2++2 +2OH-
==CaCO3¯+2H2O+CO32-
+2OH-
==CaCO3¯+2H2O+CO32-
B. 碳酸钠溶液中加入等物质的量的乙酸: CO32-+2HAc==CO2↑+H2O+2Ac-
C. 石灰水中通入过量的氟化氢: Ca2++2OH-+2HF==CaF2¯+2H2O
D. 饱和石灰水跟稀硝酸反应: Ca(OH)2+2H+=Ca2++2H2O
( C )30.下列离子方程式书写正确的是
A. 碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:
C.向50mL 1mol?L-1明矾溶液中滴入少许0.1mol?L-1Ba(OH)2溶液:
Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓
D.将SO2气体通入NaClO溶液中:SO2+H2O+ ClO-=SO42-+Cl-+2H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com