
教学时数:三课时
教学内容与步骤:
第一课时
教学要点:
1、指导学生熟读课文,整体感知课文大意;
教学重点、难点
6(2007全国高考广东卷)25(10分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
A 升高温度 B 降低温度 C 增大压强
D 减小压强 E 加入催化剂 G 移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为
。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是 。
(1)1.6×103L/mol 80%(计算过程略)
(2)B、C
(3)SO2+H2O+Na2SO3=2NaHSO3
(4)抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+
(二)非选择题
13.将10.416g纯铁丝溶于过量盐酸,在加热下用5.050g KNO?3去氧化溶液中的Fe2+ ,待反应完全后,剩余的Fe2+还需要24 mL 0.3 mol/L的KMnO4溶液才能完全氧化, 其反应方程式为:KMnO4+5FeCl2+8HCl=KCl+MnCl2+5FeCl3+4H2O,试通过计算确定KNO3的还原产物,并写出KNO3与FeCl2反应的化学方程式。
知识点:Fe2+的还原性
能力点:发散思维能力
14.混有铝的铁屑与盐酸反应,离子方程式为 ;加入适量的氢氧化钠溶液,反应的离子方程式为 、 ;再加入过量的NaOH溶液,反应的离子方程式为 ;生成的沉淀在空气中放置,发生反应的方程式为 。
知识点:Fe3+与碱的反应,Al3+与碱的反应。
能力点:归纳能力、再现能力
15.关于高炉炼铁,回答:
(1)冶铁的原料有 .
(2)焦炭的作用有二:a是 ,化学方程式为 ;b是 ,化学方程式为 、 .
(3)铁矿石的作用是 ,化学方程式(以赤铁矿 为例)为 .
(4)生石灰的作用是 ,化学方程式为 .
知识点:炼铁的过程
能力点:再现能力
16.关于氧气顶吹转炉炼钢,回答:
(1)原料是 ;
(2)生石灰的作用是 ,吹炼完毕时,加入硅铁 、锰铁或金属铝的目的是 .
知识点:炼钢的原料及作用
能力点:再现能力
17.如下图所示,A为两种元素组成的化合物,B为能使品红溶液褪色的气体,G为红褐色沉淀 ,试写出A、B、C、D、E、F、G各物质的分子式
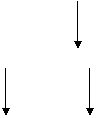 A
A  B+C
B+C
HCl
 E
D
E
D
NaOH
F G
G
知识点:Fe的化合物之间的变化关系
能力点:再现能力、归纳能力
18.在铁和氧化铁的混合物15g中加入150mL稀H2SO4放出氢气1.68L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存在。为了中和过量H2SO4,并 使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol/L NaOH,溶液200mL。求:
①混合物中铁和氧化铁各多少克?
②稀H2SO4的物质的量浓度为多少?
知识点:Fe与Fe3+的反应,以及Fe2+与碱的反应
能力点:计算能力、发散思维能力
19.某铁碳合金中已有部分铁被氧化生锈(假设铁锈成分为Fe2O3)取样品19.4g,加足量的稀盐酸使它溶解,放出氢气3.36L(标况),所得溶液中滴入硫氰化钾溶液不变色。若将溶液中的金属离子全部氧化成高价离子,需通入标况下氯气3.36L(不考虑氯气与水的反应)。 求该合金未被氧化时铁的质量分数。
知识点:Fe与HCl的反应,Fe2+的反应特点。
能力点:发散思维能力、计算能力。
(一)选择题:
1.下列物质发生反应时其离子方程式正确的是( )
A.铁与三氯化铁溶液反应
Fe+2Fe3+ 3Fe2+
3Fe2+
B.足量的氯气通入溴化亚铁溶液中
2Fe2++4Br-+3Cl2  2Fe3++2Br2+6Cl-
2Fe3++2Br2+6Cl-
C.Fe(OH)3跟盐酸反应
Fe(OH)3+3H+  Fe3++3H2O
Fe3++3H2O
D.FeS跟稀硝酸反应
FeS+2H+=Fe2++H2S↑
知识点:离子方程式的书写规则及Fe的一些重要反应
能力点:再现能力、推理能力
2.测知由Fe2(SO4)3和FeSO4组成的混合物中含硫a%,则其含铁量应为( )
A.(100-4a)% B.(100-2a)%
C.(100-a)% D.(100-3a)%
知识点:考查化合物中各元素的质量百分比
能力点:推理计算能力
3.下列试剂能用来分离Fe3+与Al3+的是( )
A.NH3·H2O B.NaOH
C.(NH4)2CO3 D.HCl
知识点:Fe3+与OH-反应与Al3+不同。
能力点:再现能力、推理能力。
4.往100mL FeBr2溶液中缓慢通入2.24L(标况)氯气,结果溶液中有1/3溴离子被氧化成溴单质,原FeBr2溶液的物质的量浓度为( )
A.1.4mol/L B.2.8 mol/L
C.1.2 mol/L D.无法计算
知识点:当Fe2+、Br-遇到强氧化剂Cl2时均表现为还原性。
能力点:计算推断能力,再现能力。
5.下列各组离子在溶液中能大量共存的是( )
A.Fe3+、S2-、HCO-3、K+
B.Fe2+、H+、NO-3、SO2-4
C.Fe3+、Mg2+、NO-3、Cl-
D.Fe2+、Cu2+、Cl-、NO-3
知识点:离子共存的条件
能力点:再现能力、发散思维能力
6.有100毫升0.1 mol/L 的FeCl3溶液与50mol 0.1mol/L的AgNO3溶液混合后,混合液各离子浓度由大到小的顺序是( )
A.[Cl-]>[Fe3+]>[Ag+]>[NO-3]
B.[Cl-]>[Fe3+]>[NO-3]>[Ag+]
C.[Fe3+]>[NO-3]>[Cl-]>[Ag+]
D.[NO-3]>[Fe3+]>[Cl-]>[Ag+]
知识点:离子浓度的计算
能力点:推理能力、发散思维能力
7.下列关于电解法精炼粗铜的叙述中不正确的是( )
A.粗铜作阳极
B.电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e=Cu
C.粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形成沉积槽底,形成阳极泥
D.电解铜的纯度可达99.95%-99.98%
知识点:电解法炼粗铜的原理。
能力点:分析综合能力。
8.在炼钢结束时,常在钢水中加一些硅铁、锰铁,其目的是( )
A.除氧化 B.还原氧化铁
C.除硫磷 D.除去过量的氧化亚铁
知识点:炼钢过程中加入一些原料的作用
能力点:再现能力、辨认能力
9.下列生产工业①制生石灰 ②制水泥 ③制普通玻璃 ④炼铁 ⑤炼钢 ⑥制漂白粉 ⑦ 硬水软化,其生产原料中直接使用石灰石的是( )
A.只有①③⑦ B.只有②④⑤
C.只有①④⑥ D.只有①②③④
知识点:一些工业生产中的原料及用途
能力点:再现能力、推断能力
10.下列有关炼铁和炼钢的说法中,错误的是( )
A.炼铁是铁矿石被还原的过程
B.炼钢是生铁被氧化的过程
C.炼铁高炉中加入石灰石的目的是除去脉石
D.炼钢转炉中加入的生石灰是造渣剂.
知识点:炼钢和炼铁的原理和目的
能力点:再现能力、推断能力
11.将10g铁碳合金放入氧气中高温灼烧,反应后的气体通入过量石灰水中得沉淀1.4g。此铁碳合金是( )
A.生铁 B.高碳钢 C.中碳钢 D.低碳钢
知识点:合金钢的定义及含碳范围
能力点:计算能力,辨析能力
12.一定量的Fe和Fe2O3组成的混合物,投入到250 mL 2mol/L的HNO3溶液中,反应完成后,生成1.12 L NO(标况);再向溶液中加入1 mol/L的NaOH溶液,要使溶液中的铁元素完全沉淀下来,所加入的NaOH溶液体积最少要( )
A.450 mL B.500 mL
C.400 mL D.无法确定
知识点:铁及铁的氧化物与酸、碱反应的一些性质。
能力点:综合计算能力。
5.炼钢
(1)设备:氧气顶吹转炉
(2)主要原料:炼钢生铁、生石灰、氧气。
(3)反应原理:利用氧化还原反应,在高温下,用氧化剂把生铁中过多的碳和其它杂质氧化为气体或炉渣除去。
(4)炼钢时的主要反应:
①氧化剂的生成,热能的来源 2Fe+O2 2FeO+Q
2FeO+Q
②降低碳的含量 C+FeO CO+Fe-Q
CO+Fe-Q
③除去S、P等杂质
④加硅铁、锰铁、铝除剩余FeO--脱氧
2FeO+Si 2Fe+SiO2
2Fe+SiO2
4.炼铁
(1)反应原理:利用氧化--还原反应,在高温下,用还原剂(主要是Co)把铁从铁矿石里还原出来。
(2)原料、铁矿石、焦炭、石灰石和空气
(3)设备:高炉
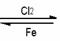
(4)生产过程
①还原剂的生成
C+O2 CO2+热 CO2+C
CO2+热 CO2+C
 2CO
2CO
②铁矿石还原成铁
Fe2O3+3CO
 2Fe+3CO2↑
2Fe+3CO2↑
③除脉石、炉渣的形成
CaCO3 CaO+CO2↑
CaO+CO2↑
SiO2+CaO CaSiO3
CaSiO3
3.铁的合金
一般地说,含碳量在2%-4.3%的铁的合金叫做生铁。生铁里除含碳外,还含有硅、锰以及少 量的硫、磷等,它可铸不可煅。根据碳的存在形式可分为炼钢生铁、铸造生铁和球墨铸铁等几种。
一般地说,含碳量在0.03%-2%的铁的合金叫做钢。钢坚硬有韧性、弹性,可以锻打、压延,也可以铸造。
钢的分类方法很多,如果按化学成分分类、钢可以分为碳素钢和合金钢两大类。碳素钢就是普通的钢,合金钢也叫特种钢,是在碳素钢是适当地加入一种或几种,如锰、铬、镍、钨、铜等合金元素而制成的。合金元素使合金钢具有各种不同的特殊性能。
2.铁的性质
(1)物理性质
银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。
(2)化学性质
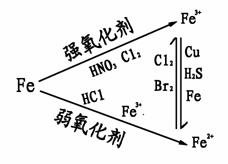 铁是较活泼的金属,常显+2、+3价,且Fe3+比Fe2+稳定。
铁是较活泼的金属,常显+2、+3价,且Fe3+比Fe2+稳定。
①铁三角
 ②铁及其重要化合物的转化关系
②铁及其重要化合物的转化关系
 ③Fe2+与Fe3+离子的检验;
③Fe2+与Fe3+离子的检验;
(1)溶液是浅绿色;
Fe2+?(2)与KSCN溶液作用不显红色,再滴氯水则变红;
(3)加NaOH溶液现象:白色沉淀--灰绿色--红褐色
 (1)与无色KSCN溶液作用显红色;
(1)与无色KSCN溶液作用显红色;
Fe3+?(2)溶液显黄色或棕黄色;
(3)加入NaOH溶液,产生红褐色沉淀。
1.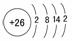 铁在周期表中的位置及结构
铁在周期表中的位置及结构
铁位于第四周期第Ⅶ族,原子结构示意图为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com