
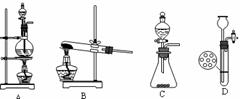
4.以下是几种常见的制气装置,其中可用于制取乙炔的是
3.三聚甲醛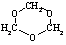 是甲醛的一种特殊商品形式,在酸的作用下,三聚甲醛可以分解为甲醛。由甲醛制取三聚甲醛的反应类型是
是甲醛的一种特殊商品形式,在酸的作用下,三聚甲醛可以分解为甲醛。由甲醛制取三聚甲醛的反应类型是
A.加成反应 B.消去反应
C.氧化反应 D.取代反应
2. 下列有机物命名正确的是
A.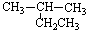 2-乙基丙烷
2-乙基丙烷
B.(CH3)2CH- 异丙基
C.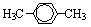 间二甲苯
间二甲苯
D.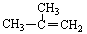 2-甲基-2-丙烯
2-甲基-2-丙烯
1.2005年诺贝尔化学奖授予法国和美国的三位科学家,以表彰他们在烯烃复分解反应研究方面作出的重要贡献。烯烃复分解反应过程被化学家描述为“交换舞伴的交谊舞”。下列图示可以被理解为烯烃复分解反应过程的是
A.
B.
C.
D.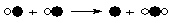
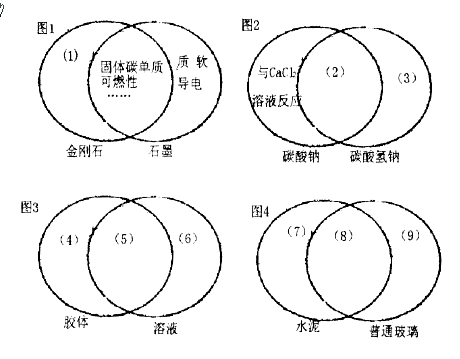
7.(威海市调研)(1)下图是一种用于显示事物异同点的信息处理方法。图1中两个圆分别代表金刚石和石墨的有关信息,两圆重叠区域表示金刚石和石墨的共同特点(相似点),重叠区域以外的部分表示它们独有的特征(不同点。)请你在下列的空格内填写适当内容。(每处只要求填一点)
(1)____________________;(3)____________________;
(6)____________________;(7)____________________;
(Ⅱ)随着铁矿的开发,某地建立了如下图所示位置关系的炼焦厂、钢铁厂、发电厂和水泥厂
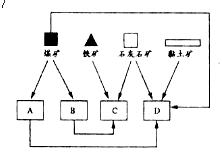
请写出图中B、D所代表的两个工厂的名称:B.__________;D._________。
答案 (Ⅰ)质硬,不导电;(3)加热分解;(6)稳定;(7)水硬性;
(Ⅱ)B.炼焦厂 D.水泥厂
5.(08山东省威海市模拟)(8分)[化学-化学与技术]
钢材厂家在生成钢材之后对其表面进行处理,形成一层致密的氧化物保护层;而使用厂家在对钢材进行加工使用前往往要除去钢材表面的氧化物,其中一种常见的方法是利用硫酸与钢材反应,此方法除去氧气的原理不是因为氧化物与酸反应,而是由于氧化物里面的金属铁与酸反应生成了氢气,使氧化物与金属分离脱落。但是在实际生产中工人师傅有几个问题请你帮助解决一下:
(1)下列哪种操作可以加快除去氧化物的速率 (填编号)
A.用浓硫酸 B.用中等浓度的硫酸
C.适当的提高温度 D.加少许铜屑
(2)反应的过程中溶液中 离子减少, 离子增加
(3)工业上在除氧化物过程中铁除了与硫酸反应外还与另一种离子反应,请写出离子方程式:
(4)为了减少废物,请你考虑可以从反应后的溶液中提取 物质。
提取分离时 → →趁热过滤
答案(1)BC(2分)(2)H+(1分),Fe2+、Fe3+(1分)2 Fe3++Fe=3 Fe2+(1分)
(4)绿矾(1分)蒸发浓缩(1分) 降温结晶(1分)
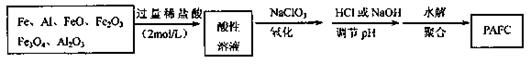 6.(08山东省威海市模拟)(14分)Ⅰ.一种新型高效净水剂PAFC(聚合氯化铁铝[AlFe(OH)uCl6-n]m),广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业来生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下:
6.(08山东省威海市模拟)(14分)Ⅰ.一种新型高效净水剂PAFC(聚合氯化铁铝[AlFe(OH)uCl6-n]m),广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业来生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下:
请回答下列问题:
(1)下列关于PAFC的说法正确的是 (填编号);
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水能电离出OH-,是一种碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(2)写出上述流程中酸性溶液加入NaClO3时,发生反应的离子方程式:
。
Ⅱ.如右图所示,一定条件下将1molO2气体和2mol SO2
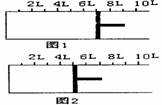 气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:
气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:
 2SO2(g)+O2(g) 2SO3(g),其中△H<0。
2SO2(g)+O2(g) 2SO3(g),其中△H<0。
当反应达到平衡时,活塞位置如图2所示,则达
到平衡时,SO2转化率为 ;该条件下
反应平衡常数为 。
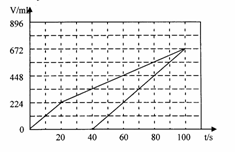
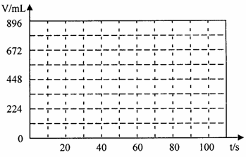 Ⅲ.某含0.02molNaCl与0.02molCuSO4的混合溶液200mL,常温下在恒定电压和电流的情况下进行电解,当40s时,阴极开始产生气体,100s时电解结束,此时两极产生的气体体积理论上相同,请在下图中画出阴阳两极产生气体的体积(已换成标准状况下的体积)与时间的关系图。
Ⅲ.某含0.02molNaCl与0.02molCuSO4的混合溶液200mL,常温下在恒定电压和电流的情况下进行电解,当40s时,阴极开始产生气体,100s时电解结束,此时两极产生的气体体积理论上相同,请在下图中画出阴阳两极产生气体的体积(已换成标准状况下的体积)与时间的关系图。
电解结束时是,消耗水的质量为
;溶液的pH为
;(体积的变化
忽略不计)
答案 I.(1)AD
(2)6Fe2++6H++ClO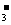 =6Fe3++Cl-+3H2O;
=6Fe3++Cl-+3H2O;
 II.85.7%;1260L·mol-1
II.85.7%;1260L·mol-1
III.0.72g;pH=1
4.(08山东省威海市08质量检测)以下物质的制备原理不正确的是
|
|
|
C.烧碱的制备:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
D.漂粉精的制备:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
3.(08山东省威海市08质量检测)氨是重要的工农业生产原料,为了进一步提高合成氨的生产效率,在科研中的研究方向正确的是 (B )
A.研制耐高温、高压的新材料 B.研制低温下活性较大的催化剂
C.研制高温下活性较大的催化剂 D.寻求氮气、氢气的新来源
1.(08山东省淄博高三模拟)(8分)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺,请按要求回答问题:
(1)“氨碱法”产生大量CaC12废弃物,请写出该工艺中产生CaC12的化学方程式:
;
(2)写出“联合制碱法”有关反应的化验学方程式:
; 。
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%)= 。
答案(1)2NH4Cl+Ca(OH)2=====2NH3↑+CaCl2+2H2O;
|
2NaHCO3=====Na2CO3+ CO2↑+H2O;(1分)
(3)“氨碱法”的CO2来源于石灰石煅烧,“联合制碱法”的CO2来源于合成氨工业的废气。(2分)
(4)由于总反映可看作是:2NH3+2NaCl+CO2+H2O=Na2CO3+2NH4Cl,所以:原子利用率(%)
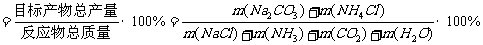 4.(08山东2、(省威海市08质量检测)下列关于工业生产的说法中,不正确的是 ( D )
4.(08山东2、(省威海市08质量检测)下列关于工业生产的说法中,不正确的是 ( D )
A.工业上,用焦炭在电炉中还原二氧化硅得到含少量杂质的粗硅
B.生产普通玻璃的主要原料有石灰石、石英和纯碱
C.工业上将粗铜进行精炼,应将粗铜连接在电源的正极
D.在高炉炼铁的反应中,焦炭为氧化剂
2.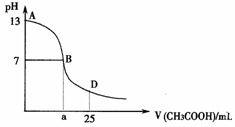 [江苏省泰州实验中学2008-2009学年度第一学期阶段Ⅱ考试 ](14分)I .右图为向25mL 0.1
mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
[江苏省泰州实验中学2008-2009学年度第一学期阶段Ⅱ考试 ](14分)I .右图为向25mL 0.1
mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)
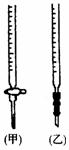
(2)关于该滴定实验,从下列选项中选出最恰当的一项 。(选填字母)
|
(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系
是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。(填“>”、“<”或“=”)
II.t℃时,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知
a+b=13 :
(5)该温度下水的离子积常数K w的数值为 。(1分)
(6)该温度下(t℃),将100mL 0.1 mol·L-1的稀H2SO4溶液与100mL 0.4 mol·L-1的
NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH= 。(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com