
2.二氧化氮存在下列平衡:2N02(g)
 N204(g);△H<0,在测定N02的相对分子质量时,下列条件中较为适宜的是( )
N204(g);△H<0,在测定N02的相对分子质量时,下列条件中较为适宜的是( )
A.温度130℃、压强3.03×105Pa
B.温度25℃、压强1.01×105Pa
C.温度130℃、压强5.05×104Pa
D.温度0℃、压强5.05×104Pa
1.下列事实中不能应用勒夏特列原理来解释的是( )
A.往硫化氢水溶液中加碱有利于S2-的增加
B.加入催化剂有利于氨氧化的反应
C.加压有利于乙烯水化制乙醇
D.高压比常压有利于合成氨的反应
4.如右图所示,将4mol SO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
 2SO3(g);△H<0。该反应达到平衡状态A时,测得气体总物质的量为4.2mol。
2SO3(g);△H<0。该反应达到平衡状态A时,测得气体总物质的量为4.2mol。
 若SO2、O2、SO3的起始物质的量分别用a、b、c表示,回答下列问题:
若SO2、O2、SO3的起始物质的量分别用a、b、c表示,回答下列问题:
(1)在达到平衡状态A的容器中通入少量O2,体系中SO2的体积分数 (填增大、减小或不变),若要使SO2的体积分数再变到与平衡状态A相同,可采取的措施有:
或 。
(2)若起始时a=1.2mo1,b=0.6mo1,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时c的取值为 。
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围为 。
检测提高
3.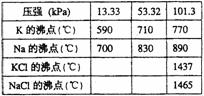 钾是-种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
钾是-种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l) NaCl(l)+K(g);ΔH>0。该反应的平衡常数可表示为:K=C(K),各物质的沸点与压强的关系见右表。
NaCl(l)+K(g);ΔH>0。该反应的平衡常数可表示为:K=C(K),各物质的沸点与压强的关系见右表。
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是 。
(3)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为:K= 。
2.在一固定容积的密闭容器中加入2 L X气体和3 L Y气体,发生如下反应:nX(g)+3Y(g)  2R(g) ;△H<0,反应达平衡时,测知X和Y的转化率分别为30%和60%,则化学方程式中的n值是( )
2R(g) ;△H<0,反应达平衡时,测知X和Y的转化率分别为30%和60%,则化学方程式中的n值是( )
A.1 B.2 C.3 D.4
1. 甲萘醌(维生素K)有止血作用,它可用2-甲基萘氧化制得,反应中常用乙酸做催化剂,该反应放热,可表示为
甲萘醌(维生素K)有止血作用,它可用2-甲基萘氧化制得,反应中常用乙酸做催化剂,该反应放热,可表示为
在某次合成反应中,用1.4g(0.01mol)的2-甲基萘才制得0.17g(0.001 mol)甲萘醌。巳知该次合成反应的速率是快的。导致产率低的原因是( )
A.使用了过量的氧化剂
B.把反应混合物加热
C.没有用乙酸做催化剂而改用其他催化剂
D.所生成的甲萘醌为沉淀物
3.运用气体状态方程解题时,要注意前提条件,否则比例关系错误。
纠错训练
2.进行有关化学反应速率与化学平衡的计算时,要理清起始量、变化量、平衡量之间关系,易混淆出错。
1.工业生产适宜条件的选择原则
(1)既要注意外界条件对化学反应速率和化学平衡影响的一致性,又要注意对二者影响的矛盾性。
(2)既要注意温度、催化剂对速率影响的一致性,又要注意催化剂的活性对温度的限制。
(3)既要注意理论生产,又要注意实际可能性。
9.在一定条件下,把1molN2、1molH2通到一个容积不变的密闭容器中,发生如下反应:N2十3H2 2NH3,当此反应平衡时,容器内气体压强为P。
2NH3,当此反应平衡时,容器内气体压强为P。
(1)若在上述完全相同的容器中,保持温度不变,通人1/3molNH3,若要使平衡时能使容器内压强仍为P,则需加入N2和H2的物质的量各为多少?
(2)平衡时,N2、NH3的物质的量的范围各是多少?
(3)欲使平衡时,H2和NH3均为1/2mol,你认为是否有可能?
(本题测试学生对化学平衡的定量理解及相关计算的基本技能。答题时要确立等效平衡关系,利用假设法分析推理求之。)
第13课时 化学平衡的应用及计算(B卷)
易错现象
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com