
15.石油化工是江苏省的支柱产业之一。聚氯乙烯是用途十分广泛的石油化工产品,某化工厂曾利用下列工艺生产聚氯乙烯的单体氯乙烯:
CH2=CH2+Cl2→CH2Cl-CH2C1……①
CH2Cl-CH2C1→CH2=CHCl+HCl……②
请回答以下问题:
(1)已知反应①中二氯乙烷的产率(产率= ×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯______t,同时得到副产物氯化氢_______t。(计算结果保留1位小数)
×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯______t,同时得到副产物氯化氢_______t。(计算结果保留1位小数)
(2)为充分利用副产物氯化氢,该工厂后来将下列反应运用于生产:
2CH2=CH2+4HCl+O2→2 CH2Cl-CH2C1+2H2O…③
由反应①、③获得二氯乙烷,再将二氯乙烷通过反应②得到氯乙烯和副产物氯化氢,副产物氯化氢供反应③使用,形成了新的工艺。由于副反应的存在,生产中投入的乙烯全部被消耗时,反应①、③中二氯乙烷的产率依次为a%、c%;二氯乙烷全部被消耗时,反应②中氯化氢的产率为b%。试计算:反应①、③中乙烯的投料比为多少时,新工艺既不需要购进氯化氢为原料,又没有副产物氯化氢剩余(假设在发生的副反应中既不生成氯化氢,也不消耗氯化氢)。
14.ag镁在盛有bL(标准状况)CO2和O2混合气的密闭容器中燃烧。
(1)在密闭容器中可能发生的化学反应有____________________________。
(2)若反应后容器中CO2有剩余,则容器内的固体物质一定含有______。
(3)若反应后容器中O2有剩余,则容器内固体物质的质量为________,此时,在bLCO2和O2的混合气体中氧气体积V(O2)必须满足的条件是_____。
(4)若反应后容器中无气体剩余,则容器内固体物质的质量(m)的取值范围为_________________。
13.标准状况下,5.6 L CO、CO2、HCHO组成的混合气体的质量为7.5 g。将该混合气体依次通过足量灼热的CuO、浓硫酸和碱石灰,使反应充分。
(1)已知HCHO与灼热CuO反应生成Cu、CO2和H2O,试写出该反应的化学方程式:
。
(2)原混合气体中,CO、CO2、HCHO的体积比可能为 。(填字母代号)
A.1:1:1 B.7:1:8 C.14:2:9 D.7:11:18
(3)欲进一步确定混合气体中各组分的体积分数,只需确定下列数据中的一项就能达到目的,这(些)数据是 (填代号)。
①混合气体的密度ρg·cm-3 ②浓硫酸的增重m1 g ③碱石灰的增重m2 g ④CuO质量的减少m3 g
(4)根据(3)的判断结果,写出一个原混合气体中HCHO体积分数的计算式: 。
12.已知将Cl2通入浓氨水中可发生下列反应:3Cl2+8NH3=6NH4Cl+N2,使体积为1.12L、质量为3.335g的Cl2和N2的混合气体通过浓氨水,体积变为0.672L(其中Cl2和N2各占50%,以上体积均在标准状况下测定_。
(1)下面是三位同学从不同角度解此题的第一步算式,试判断未知数x的意义,并填入下表:
|
|
第一步算式 |
x表示的意义 |
|
甲 |
(3-1):2=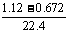 :x :x |
|
|
乙 |
3:(x-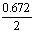 )=1:[ )=1:[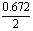 -(1.12-x)] -(1.12-x)] |
|
|
丙 |
71x+28(1-x)= ×22.4 ×22.4 |
|
(2)计算被氧化氨的质量。
11.a mol铁和bmol硫磺在隔绝空气条件下加热,使两者充分反应,然后将反应混合物与足量稀硫酸溶液在适当的条件下反应,通过计算回答:
(1)生成的气体在标准状况下的体积(L)为 。
(2)生成的气体在标准状况下的密度d(g·L-1)的取值范围(用分数表示) 。
(3)若生成的气体不小于bmol时,则a、b的关系为 。
(4)当a + b=1时,欲使产生的气体的密度为最大值,则a、b的取值范围各为多少 。
10.黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分燃烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL。
已知:SO2+2Fe3++2H2O = SO42 -+2Fe2++4H+、 +6Fe2++14H+ = 2Cr3++6Fe3++7H2O
+6Fe2++14H+ = 2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应)________________。
(2)若燃烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式____________________。煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_________L,制得98%的硫酸质量为________t,SO2全部转化为H2SO4时放出的热量是___________kJ。
9.铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2
 2PbO+2SO2;③制粗铅:PbO+C
2PbO+2SO2;③制粗铅:PbO+C Pb+CO;PbO+CO
Pb+CO;PbO+CO Pb+CO2。
Pb+CO2。
下列说法正确的是
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1molPb共转移2mol电子D.将1molPbS冶炼成Pb理论上至少需要6g碳
8.将质量为w1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的HCl溶液,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2 L。将溶液蒸干灼烧得固体w2g。下列所列关系式中正确的是
A.35.5a V2 =w2-w1 B.23n(Na)+27n(Al)=w1
C. n(Na)+3n(Al)= D. a V2
=
D. a V2
=
7.有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO)
A.0.448L B.0.672 C.0.896 D.0.224
6.不溶于水的Cu2O,可溶于含H2SO4的Fe2(SO4)3溶液中,其化学方程式为:
Cu2O+Fe2(SO4)3+H2SO4=2CuSO4+2FeSO4+H2O此时生成的FeSO4可用KMnO4的H2SO4溶液滴定,还原产物为MnSO4,通过这样的方法可测定Cu2O的含量,则每消耗0.1mol·L-1KMnO4的H2SO4溶液1mL,相当于含Cu2O
A. 3.6 ×10-2g B.7.2 ×10-3g
C.3.5 ×10-2g D.3.6 ×10-3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com