
17、(1)SO3十H2O H2SO4(化合反应)
H2SO4(化合反应)
(2)2KMnO4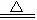 K2MnO4十MnO2+O2↑(分解反应)
K2MnO4十MnO2+O2↑(分解反应)
(3)Fe2O3+6HCl 2FeCl3+3H2O(复分解反应)
2FeCl3+3H2O(复分解反应)
(4)3CuO+2Al A12O3+3Cu(置换反应)
A12O3+3Cu(置换反应)
解析:该题的命题目的是考查对化学反应四种基本类型的各类反应的涵义的理解与应用能力,并能熟练地书写常见物质发生化学反应的化学方程式。解题时,正确地写出有关化学方程式,将之与四种基本类型的化学反应的定义相联系,确定各化学反应所属的反应类型。
16、(1)Zn+2HCl ZnCl2+H2↑
ZnCl2+H2↑
(2)2H2+O2 2H2O
2H2O
(3)C+CO2 2CO
2CO
(4)2KMnO4 K2MnO4+MnO2+O2↑(或其他合理答案)
K2MnO4+MnO2+O2↑(或其他合理答案)
15、A解析:氧化性就是得电子而使组成酸的元素化合价降低,而酸性是提供H+而留下酸根。用此标准分析每个反应,知答案为A。
点评:此题将氧化还原反应和酸的有关概念放在一起进行考查,需要全面考虑,所考查的知识点也是考试的热点。
14、C 解析:

 ;
;

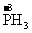 ,故P单质既被氧化又被还原。
,故P单质既被氧化又被还原。
点评:元素化合价的变化是氧化还原反应的特征,所以此题通过分析P的化合价的前后变化来判断。
13、CD解析:氧化还原反应的实质是电子的转移(得失或偏移),而其特征是反应前后元素的化合价发生改变,故化合价是分析氧化还原反应的基础。
A中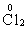

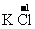

B中


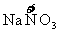
都有价态变化,所以是氧化还原反应。
C中


D中

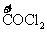
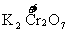


都没有化合价的改变,故都不是氧化还原反应。
12、D 解析:亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,维生素C所起的作用必定是将Fe3+离子重新转变为Fe2+离子,这说明维生素C具有还原性。
11、D 解析:氧化产物指的是还原剂被氧化后所得到的产物,该反应中为Cl2。
10、A解析:加入还原剂,使之发生还原反应,化合价会降低。故本题可借助化合价的变化来加以判断,在上述变化过程中,某元素的化合价降低,则需加入还原剂来实现,答案选A。
9、C 解析:A.H2O作氧化剂,B.H2O既不是氧化剂,又不是还原剂,D非氧化还原反应。
8、C 解析:根据氧化还原反应中被氧化的元素是失去电子的元素即化合价升高的元素,上述反应中,Fe元素从+2价升高到+3价,Br元素从-1价升高到0价,所以被氧化的元素是Fe和Br,选C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com