
1.①②⑧; ③④⑨;⑤;⑥⑦⑩
14. ⑴在“O”点处醋酸未电离,无离子存在 。⑵c<a<b 。 ⑶c ⑷C、E、F
第14课时 (B卷)
纠错训练
13. (1)100 mL溶量瓶(注:未标明规格的扣1分) (2)> b (3)配制pH=1的HA溶液难以实现,不妥之处在于加入的锌粒难以做到表面积相同 (4)配制NaA溶液,测其pH>7即证明HA是弱电解质
讲析:甲、乙两同学都是利用了第一个原理。0.1mol·L-1的HA溶液pH>1,说明c(H+)<0.1 mol·L-1也就说明了HA不能完全电离,为弱电解质。同pH的盐酸和HA用水稀释相同倍数后,由于HA是弱电解质,存在电离平衡,c(H+)减小程度小,溶液中c(H+)大于盐酸中c(H+),与锌粒反应速率快。再由原理二,就很容易地设计出另外一个更为简易的方案:配制NaA溶液,测其pH>7即证明HA是弱电解质。另外解此题第一问时,很易丢容量瓶的容积,要注意答题的严密性。
12. A
11.
|
条件 |
平衡移动方向 |
NH4+的物质的量 |
n(OH-) |
c(NH4+) |
|
加少量盐酸 |
正 |
增 |
减 |
增 |
|
加少量固体NaOH |
逆 |
减 |
增 |
减 |
|
加水稀释 |
正 |
增 |
减 |
减 |
|
通入NH3 |
正 |
增 |
增 |
增 |
|
升高温度 |
逆 |
减 |
减 |
减 |
|
加NH4NO3晶体 |
逆 |
增 |
减 |
增 |
1.D 2.A 3.C 4.AD 5.A 6.B 7.D 8.D 9.A 10.A
1.C 2.B 3.B 4.C
讲析:2.溶液混合后导电能力变化的大小,关键看混合后溶液中自由移动离子的浓度的变化。由于自来水几乎不导电,加入0.05
mol NaOH后,导电性突然增大;醋酸是弱电解质,加入NaOH后,生成强电解质CH3COONa,导电性明显增强;0.5 mol·L-1的KCl中加入0.05
mol NaOH固体后,离子浓度增大,导电能力增强;只有0.5 mol·L-1的盐酸,能与NaOH反应生成强电解质NaCl,不影响导电性。
3.温度不变时,c(H+)和c(OH-)的乘积为常数,故排除C;稀释时电离度增大,c(OH-)的物质的量增大,故排除D;稀释时,NH3·H2O的物质的量减小,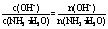 ,可知该分数值增加,故排除A选B。 4.D项加入水会增大CH3COOH的电离度,不符合题意。B选项加NH3·H2O,中和CH3COOH电离出的H+,增大CH3COOH溶液的pH,同时还增大CH3COOH的电离度,也不符合题意。A选项加入CH3COONa,增大了CH3CO0-离子浓度,抑制CH3COOH的电离,但同时也降低了c(H+)浓度,虽然电离度减小了,但pH增大了,也不符合题意。C选项加HCl,增大了c(H+)浓度,使CH3COOH电离平衡逆向移动,降低其电离度,又增加它的酸性,pH降低。
,可知该分数值增加,故排除A选B。 4.D项加入水会增大CH3COOH的电离度,不符合题意。B选项加NH3·H2O,中和CH3COOH电离出的H+,增大CH3COOH溶液的pH,同时还增大CH3COOH的电离度,也不符合题意。A选项加入CH3COONa,增大了CH3CO0-离子浓度,抑制CH3COOH的电离,但同时也降低了c(H+)浓度,虽然电离度减小了,但pH增大了,也不符合题意。C选项加HCl,增大了c(H+)浓度,使CH3COOH电离平衡逆向移动,降低其电离度,又增加它的酸性,pH降低。
新活题网站
17.若在现代原子结构理论中,假定每个原子轨道只能容纳一个电子,则原子序数为42的元素的核外电子排布式将是怎样的 ________________________________;按这种假设而设计出的元素周期表,该元素将属于第________周期,第_______族。
16.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质);
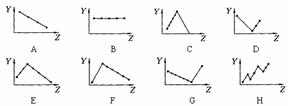 把与下面的元素有关性质相符的曲线的标号填入相应括号中:
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数( )
(2)ⅦA族元素氢化物的沸点( )
(3)第三周期元素单质的熔点( )
(4)第三周期元素的最高正化合价( )
(5)IA族元素单质熔点( )
(6)F-、Na+、Mg2+、Al3+四种离子的离子半径( )
(7)短周期元素的原子半径( )
(8)短周期元素的第一电离能( )
15.下列物质转化关系中,A是人类最早通过“湿法冶炼”得到的金属单质,也是人类最早用作制镜的材料,K是现在用作制镜材料的金属单质,I为日常生活中最常见的金属之一;E是由两种核电荷数均小于10的元素组成的化合物,其中一种元素的原子半径在所有原子中最小,另一种元素的基态原子最外能层中的p能级处于半充满状态;K元素和A元素在元素周期表中处于同一列且比A元素多18个电子;H是深蓝色溶液,J是含有K离子的可溶性盐(下列物质转化关系中与本题无关的物质均被略去)。回答下列问题:
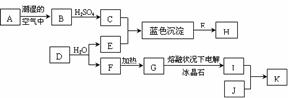
(1)A的化学式为 ,H中阳离子的化学式为 ,空间构型为___________形。
(2)G转化为I的化学方程式是 ;
(3)D由两种元素组成,且这两种元素在D中的物质的量之比为1∶1,D转化为E、F的反应为复分解反应,请写出该反应的化学方程式 ;
(4)在J溶液逐渐加入过量E的水溶液,会发生类似于C转化为H的过程而形成一种配离子,该配离子的中心离子配位数为2,且该中心离子采用sp杂化与E分子结合。该配离子的化学式为 ,空间构型为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com