
2.下列溶液中加入少量NaOH固体导电能力变化不大的是( )
A 盐酸 B CH3COOH C NH3·H2O D H2O
(本题考查了电解质溶液的导电能力问题,关键抓住溶液的导电性一定与溶液中自由移动离子的浓度成正比)
1.下列化合物属于弱电解质的是 ( )
A HClO4 B Ba(OH)2 C CO2 D HF
(该题考查了学生对弱电解质包括的物质类别,注意辨别非电解质)
4.当CH3COOH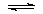 CH3COO-+H+已达平衡,若要使醋酸的电离平衡向左移动和溶液的pH值都减小,应加入的试剂是( )
CH3COO-+H+已达平衡,若要使醋酸的电离平衡向左移动和溶液的pH值都减小,应加入的试剂是( )
A.CH3COONa B.NH3·H2O
C. HCl D.H2O
(此题是属于电离平衡移动的问题,目的是考查运用电离平衡移动原理解决如何使弱电解质CH3COOH的电离平衡发生如题干所需的改变,答题时要兼顾选择一种合适的试剂来满足题干中提出的:既要降低电离度,又要减小pH的两个条件。)
新活题网站
3. (1999年上海高考)把0.05 mol NaOH固体分别加入到100 mL 下列液体中,溶液的导电能力变化最小的是( )
A.自来水 B.0.5 mol·L-1盐酸
C.0.5 mol·L-1CH3COOH溶液 D.0.5 mol·L-1KCl溶液
(该题考查的问题是电解质溶液的导电能力,注意电解质的导电能力主要由溶液中离子的浓度和电荷数决定)
2.( 2000南通二模))用水稀释0.1 mol·L-1氨水时,溶液中随着水量的增加而减小的是( )
A.c(OH-)/c(NH3·H2O) B.c(NH3·H2O)/(OH-)
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
(该题考查了学生加水稀释对弱电解质电离平衡的影响)
1.关于强弱电解质的叙述正确的是 ( )
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.强电解质的稀溶液中无溶质分子,弱电解质的溶液中存在溶质分子
D.弱电解质的水溶液的导电能力比强电解质溶液弱
(该题考查学生对强弱电解质的概念的理解和掌握)
3.掌握电离常数的概念及一元弱酸,一元弱碱的电离常数表达式
典型题点击
2.理解并掌握弱电解质的电离平衡
⑴概念:在一定条件下下,当电解质分子电离成离子的速率与离子重新结合生成分子的速率相等时,电离过程就达到了平衡状态。
 ⑵弱电解质的电离平衡的特点
⑵弱电解质的电离平衡的特点

1. 掌握强弱电解质与结构的关系
|
|
强电解质 |
弱电解质 |
|
定义 |
溶于水以后几乎完全电离的电解质 |
溶于溶于水以后几乎完全电离的电解质 |
|
电离特点 |
完全电离、不可逆、不存在电离平衡 |
部分电离、可逆、存在电离平衡 |
|
物质种类 |
强酸、强碱、多数盐、碱性氧化物 |
弱酸、弱碱、水 |
|
溶质粒子种类 |
水合离子、无溶质分子 |
水合离子和溶质分子共存 |
|
化学键 |
离子键、强极性键 |
一般为弱极性键 |
2.电解质溶液导电能力的强弱
⑴电解质溶液的导电机理:自由离子(阴阳)定向迁移形成电流。
⑵溶液的导电能力:主要由溶液中离子的浓度和电荷数决定
⑶溶液导电能力的影响因素:
内因: 电解质本身电离能力
外因:温度、溶液浓度等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com