
2、橙色世界
(1)基态:浓溴水 、甲基橙试剂、Br2 (CCl4)呈橙红色。
(2)化学变化:甲基橙在酸性溶液(3.1<pH< 4.4)中呈橙色,甲基红在酸性溶液(4.4<pH< 6.0)中呈橙色。
1、红色世界
(1)基态:Fe2O3 (红褐色)、Fe (OH)3 (红 棕色)、[Fe (SCN)]2+ (血红色)、Cu (紫红色)、Cu2O (砖红色)、NO2 (红棕色)、P(红磷、暗红色)、Br2 (深红棕色)、红色石蕊试纸、 品红溶液。
(2)激发态:充氦气的灯光呈粉红色,充氖气的灯光呈红色,钙元素的焰色呈砖红色。
(3)化学变化:
①紫色石蕊在酸性溶液(pH<5.0)中变红,
②润湿的蓝色石蕊试纸遇酸性(CO2、SO2 、H2S 、HCl)变红,
③酚酞在碱性溶液中呈浅红色(8.2<pH<10.0)或红色(pH>10),
④甲基橙在酸性溶液(pH<3.1)中呈红色,
⑤甲基红在酸性溶液(pH<4.4)中呈红色,
⑥pH试纸(黄色)遇酸性溶液(pH<2)变红,
⑦已经被二氧化硫褪色的品红溶液在加热时会出现红色,
⑧C(NaHSO4)>0.001mol/L时遇甲基橙变红。
2.常见阴离子的检验
|
物质 |
检验方法 |
|
OH- |
能使① 无色酚酞、② 紫色石蕊、③ 橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。 |
|
C1- |
能与AgNO3溶液反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成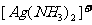 。 。 |
|
Br- |
能与AgNO3溶液反应,生成淡黄色AgBr沉淀,沉淀不溶于稀HNO3。 |
|
I- |
① 能与AgNO3反应,生成黄色AgI沉淀,沉淀不溶于稀HNO3。② I-也能与氯水反应生成I2,使淀粉溶液变蓝 |
|
SO42- |
能与含Ba2+溶液反应,生成白色BaSO4沉淀,沉淀不溶于硝酸。 |
|
SO32- |
① 浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色。② 能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体。注:BaSO3在硝酸中也不溶解,而是转化为BaSO4沉淀,但有NOx放出。 |
|
S2- |
能与Pb(NO3)2或CuSO4溶液反应,生成黑色PbS或CuS沉淀。 |
|
CO32- |
能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味能使澄清石灰水变浑浊的CO2气体。 |
|
HCO3- |
① 取含HCO3-盐溶液煮沸,放出无色无味CO2气体,气体能使澄清石灰水变浑浊。或 ② 向HCO3-盐酸溶液里加入稀MgSO4溶液,无现象,加热煮沸,有白色沉淀生成,同时放出CO2气体。 |
|
PO43- |
含PO43-的中性溶液,能与AgNO3反应,生成黄色Ag3PO4沉淀,该沉淀溶于硝酸。 |
|
NO3- |
浓溶液或晶体中加入铜片、浓H2SO4加热,放出红棕色气体。有关反应方程式为:NO3-+H2SO4=HSO4-+HNO3,Cu+4HNO3 Cu(NO3)2+2NO2↑+ 2H2O。 Cu(NO3)2+2NO2↑+ 2H2O。 |
特别提醒:无机物鉴别颜色方面的突破口:
1.常见阳离子的检验
|
物质 |
检验方法 |
|
H+ |
能使紫色石蕊试液或橙色的甲基橙试液变为红色。 |
|
Na+、K+ |
用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过蓝色钴玻璃片观察钾离子焰色)。 |
|
Ba2+ |
能使稀H2SO4或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀HNO3。 |
|
Mg2+ |
能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。 |
|
Al3+ |
能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。 |
|
Ag+ |
能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀HNO3,但溶于氨水,生成 [Ag(NH3)2]+。 |
|
NH4+ |
铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蕊试纸变蓝或有刺激性气味的NH3气体。 |
|
Fe2+ |
能与少量NaOH溶液反应,开始时生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。有关反应方程式为:2Fe2+ + Cl2=2Fe3+
+ 2Cl-。 |
|
Fe3+ |
能与KSCN溶液反应,变为血红色溶液;能与NaOH溶液反应,生成红褐色Fe(OH)3沉淀。 |
|
Cu2+ |
蓝色溶液(浓的CuCl2溶液显绿色)能与NaOH溶液反应,生成蓝色的
沉淀,加热后可转变为黑色的CuO沉淀。含Cu2+溶液能与Fe、Zn片等反应,在金属片上有红色的铜生成。 |
2.物质分离提纯的常用方法
①物理方法: 过滤、结晶重结晶、蒸发、蒸馏、分馏、分液、萃取、升华、渗析、溶解、盐析、洗气等。
②化学方法:
(1)加热法:混合物中混有 性差的物质时,可直接加热,使热稳定性差的物质分解而分离出去,有时受热后能变为被提纯的物质。例如,食盐中混有氯化铵。
(2)沉淀法:在混合物中加入某试剂,使其中一种以沉淀形式分离出去的方法。使用该种方法一定要注意不能引入新 。若使用多种试剂将溶液中不同离子逐一沉淀,这时应注意后加试剂能将先加试剂的过量部分除去,最后加的试剂不引入新杂质。例如,加适量BaCl2溶液除去NaCl中的Na2SO4。
(3)转化法:不能通过一次反应达到分离的目的,而要经过转化为其他物质才能分离,然后在将转化物质恢复为原物质。例如,苯酚中混有硝基苯时,先加入NaOH溶液后分液,再向苯酚钠溶液中通入CO2重新生成苯酚等。注意转化过程中尽量减少被分离物的损失。
(4)酸碱法:被提纯物不与酸反应,而杂质与酸可反应,用酸作除杂试剂;被提纯物不与碱反应,而杂质与碱易反应,用碱作除杂试剂。例如,用氢氧化钠除去铁粉中的铝粉。
(5)氧化还原法:对混合物中含有还原性杂质,加入适当氧化剂使其氧化为被提纯物质;对混合物中含氧化性杂质,可加入适当还原剂将其还原为被提纯物质。例如,FeCl2中含有FeCl3,加入铁粉,振荡过滤,即可除去FeCl3而又不引入新的杂质。
②化学方法:加热法、沉淀法、转化法、酸碱法、氧化还原法等。
特别提醒:在解答物质提纯试题时,选择试剂和实验措施应考虑三个方面:①不能引入新杂质;②提纯后的物质成分不变;③实验过程和操作方法简单易行。
[例1](黄冈中学2009届高三月考)下列各组混合物的分离或提纯方法不正确的是( )
A.用过滤法分离Fe(OH)3胶体和FeCl3溶液的混合物
B.用结晶法提纯NaCl和KNO3的混合物中的KNO3
C.用蒸馏法分离乙醇和苯酚的混合物
D.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
[解析]胶体不能透过半透膜,能透过滤纸,不能用过滤的方法分离Fe(OH)3胶体和FeCl3溶液的混合物。
答案:A
考点2 物质的检验
1.物质的分离、提纯的一般原则:分离或提纯一般应遵循 “两不两易”原则,即不增加 ,不减少所需物质,所选试剂便宜易得,欲得物质易于 。
实验室五防:(1)防 (2)防 (3)防 (4)防 (5)防堵塞:
特别提醒: 为保证试剂存放安全、减少变质,常用化学试剂的保存应注意以下几点:
①防氧化(隔离空气):如活动金属(钠、钾)应保存在煤油里;少量白磷要在水中保存。
②防吸收空气中的水和酸性气体:固体烧碱、浓硫酸、生石灰、碱石灰、电石、过氧化钠等,因易吸收水或二氧化碳,应密封在试剂瓶中保存。
③防见光分解:浓硝酸、溴水、新制氯水、硝酸银溶液、硝酸盐等见光易分解变质的物质,应保存在棕色瓶中。
④防挥发:浓硝酸、浓盐酸、液溴、浓氨水、碳酸氢铵等易挥发或易分解的试液,要放在阴凉处;液溴也要用冷水来密封保存。
⑤防瓶塞打不开或腐蚀试剂瓶:强碱溶液、浓氨水、水玻璃(Na2SiO3溶液)、碳酸钠溶液等碱性试剂,应放在带胶塞(不得用玻璃塞)的试剂瓶中保存;氢氟酸应保存在塑料瓶中。
[例5](广东省实验中学2008学年高三第二次阶段测试试卷 )下列叙述中正确的是( )
A.碘易升华所以要保存在铁盖旋紧的试剂瓶中
B.液溴应保存在磨口玻璃棕色试剂瓶中,并加少量水进行水封
C.碘易溶于酒精,所以用酒精从碘水中萃取碘
D.能使湿润淀粉碘化钾试纸变蓝的气体可能是氯气
[解析]A项碘易升华所以要保存在棕色的试剂瓶中;C项酒精与水互溶,所以不能用酒精从碘水中萃取碘。
(二)取用试剂的一般原则:
1.化学药品很多是有毒或有有腐蚀性、易燃或易爆的。取用药品时要严格做到“三不”:不能用 接触药品,不要把 凑到容器口去闻药品(特别是气体)的气味,不得 任何药品的味道。
2.注意节约药品。严格按照实验规定的用量取用药品。如果没有说明用量,一般应按最少量取用,液体 毫升,固体只盖试管底部。
3.取用粉末状或小颗粒状固体用 ,若 不能伸入试管,可用 ,要把药品送入试管底部,而不能沾在管口和管壁。块状和大颗粒固体 夹取。
4.取少量液体可用胶头滴管。取用较多的液体用倾注法,注意试剂瓶上的标签向 。向容量瓶、漏斗中倾注液体时,要用 引流。
5.用剩的药品不能 ,以免污染试剂;也不能随意抛洒,以免发生事故。要放入指定的容器中。
(一)试剂存放的一般原则:
1.固体试剂装在 口瓶中,液体试剂装在 口瓶中,见光易分解的装在 色瓶中,放在 低温处。如AgNO3固体装在棕色广口瓶中,浓HNO3装在棕色细口瓶中。
2.易挥发或易升华的要密封保存。如液溴易挥发,装在棕色细口瓶中,加适量 覆盖在液溴表面,起水封作用。碘易升华,装在 色广口瓶中密封保存。
3.能腐蚀玻璃的如氢氟酸不能用 瓶装,而装入塑料瓶中。能使玻璃试剂瓶瓶塞与瓶颈磨砂部分粘连的,如NaOH、KOH等强碱溶液和水玻璃等碱性溶液不能用 塞,通常用
塞。而能使 腐蚀的液溴、浓HNO3和使橡皮溶胀的有机溶剂如汽油、苯、甲苯等只能用玻璃塞而不能用橡皮塞。
4.有些试剂能与空气中O2、H2O(g)、CO2等发生反应,要根据试剂的性质选用不同的方法隔绝空气。如钾、钙、钠易与空气中的O2和水蒸气反应,实验室中通常保存在 中(锂的密度比煤油小,会浮在煤油上,通常保存 中);白磷易在空气中缓慢氧化而自燃,实验室保存在 中;固体NaOH易 要密封保存;Na2O2、电石等易空气中的水蒸气反应,都要密封保存。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com