
2.一定物质的量浓度溶液的配制。
一定物质的量浓度溶液的配制步骤一般有五步:
①计算:计算出所需固体溶质的 或液体溶质的 。
②称量:用托盘天平称取固体溶质的 或用合适的量筒取液体溶质的 。
③溶解:将溶质倒入 中,加适量蒸馏水,用 搅拌,使溶质全部溶解,冷却到 ,用玻璃棒 ,把溶液注入一定容量的 。
④洗涤:用适量蒸馏水洗涤 和 2-3次,并将洗涤注入 。振荡,使溶液混合均匀。
⑤定容:继续向容量瓶中小心地加蒸馏水,至液面离刻度 厘米处,改用 加入至 底端与刻度线相切。塞好瓶塞,反复摇匀。将配好溶液转移到试剂瓶或容器中。
[例2]实验室配制480 mL 0.1 mol·L-1Na2CO3溶液,完成下列问题:
(1)应用托盘天平称取无水碳酸钠粉末__________g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠粉末是__________g(1 g以下用游码)。
(3)配制Na2CO3溶液时需用的主要仪器有________、_______、______、______、_______。
(4)使用容量瓶配制溶液时,下列情况会使所配溶液浓度偏低的是__________。
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 ②无水碳酸钠粉末已部分吸水变成晶体 ③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 ④转移溶液前容量瓶内有少量蒸馏水 ⑤定容时,俯视容量瓶的刻度线 ⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
[解析]在实验室中不存在480 mL的容量瓶,所以应取500 mL的容量瓶配制溶液。若物品与砝码的位置颠倒,当不使用游码时,不产生误差;当使用游码时,物品的质量为砝码的质量减去游码指示的质量,也就是比应称量的质量少游码指示的质量的二倍。在进行误差分析时,可以从公式 c=n/V着手分析。
答案:(1)5.3 (2)4.7 (3)500 mL容量瓶 托盘天平 玻璃棒 胶头滴管 烧杯
(4)①②③⑥
[方法技巧]配制溶液用的容量瓶的规格通常有25mL、50mL、100mL、250mL、500mL、1L;若物品与砝码的位置颠倒则应称量的质量少游码指示的质量的二倍;误差分析可以从公式着手分析。
考点3.滴定实验
1.一定溶质质量分数溶液的配制。
2.硫酸铜晶体中结晶水含量的测定
(1)实验原理:硫酸铜晶体是一种比较稳定的结晶水合物,当加热到258℃左右结晶水全部失去,据加热前后的质量差,可推算出其晶体的结晶水含量。
设硫酸铜晶体为CuSO4·xH2O。
=或∶=
[m(H2O)=m(CuSO4·xH2O+瓷坩埚)-m(CuSO4+瓷坩埚)]
(2)实验步骤:“四称”、“两热”
(1)称坩埚(W1g);(2)称坩埚及晶体(W2g);(3)加热至晶体完全 ;
(4)冷却称重(W3g);(5)再 ;(6)冷却称量(两次称量误差不得超过 g);
(7)计算(设分子式为CuSO4·xH2O)。 x=
[特别提醒]:注意化学实验中收集有关数据,学会对数据、图表的分析处理,并科学地得出结论。
[例1](山西省实验中学09届高三月考)在测定硫酸铜晶体中结晶水的含量的实验操作中:
(1)加热前晶体应该放在 中研碎,加热时是放在 中进行,加热失水后,应放在 中冷却。
(2)判断是否完全失水的方法是 。
(3)做此实验时,最少应该进行称量操作 次。
(4)下面是某学生一次实验的数据,请完成计算,填入下面的表中。
|
坩埚质量 |
坩埚与晶体的总质量 |
加热后坩埚与固体的总质量 |
测得晶体中结晶水个数 |
|
11.7g |
22.7g |
18.6g |
|
(5)这次实验中产生误差的原因可能是( ) (填选项)
A.硫酸铜晶体中含有不挥发的杂质B.实验前晶体表面有水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
[解析]本题可以通过对硫酸铜晶体中结晶水含量的测定实验的复习逐一解答.
实验仪器:托盘天平、研钵、酒精灯、玻璃棒、坩埚 、三角架、泥三角、坩埚钳、干燥器
实验步骤:“四称”、“两热”、“ 一算”
计算:(设化学式为CuSO4·nH2O)
n=160(m2-m3)/(m3-m1)
答案:(1)研体 坩埚 干燥器
(2)最后连续两次加热冷却后称量的质量差不超过0.1g
(3)4 (4)5.3g (5)BC
[方法技巧] 硫酸铜晶体中结晶水含量的测定实验中除了要熟练掌握实验所需要的仪器和实验步骤外,还应当注意几个事项:一是坩埚可以直接加热,要放到泥三角上,二是加热完全失去结晶水后,坩埚要放到干燥器中冷却以免无水硫酸铜吸水。
考点2 溶液的配制
1.中和热的测定
8、白色世界
(1)基态:Pb(蓝白色)、Hg、铝粉、大多数块状金属、 PbSO4 、BaSO4 、AgCl 、BaCO3 、 Ba3(PO4)2 、BaSO3 、CaCO3 、 Fe (OH)2 (不稳定)、 Mg (OH)2 、 Al (OH)3 、 ZnS
(2)化学变化:
①H2在Cl2中燃烧呈现苍白色火焰,
②NH3遇 HCl 产生白烟,
③Mg 、 Al在氧气中燃烧发出耀眼的白光
④红磷在氯气中燃烧时产生白色烟雾,
⑤红磷在氧气中燃烧时产生白烟。
[例2]只用一种试剂即可区别NaBr、NaI、NaOH、Na2CO3、NaSCN、H2S、AgNO3、C6H5OH等八种无色溶液,这种试剂为( )
A.硫酸 B.氨水 C.FeCl3溶液 D.盐酸
[解析]FeCl3溶液与NaBr不反应,与NaI反应生成I2产生紫色沉淀,与NaOH生成Fe(OH)3 红褐色沉淀,与Na2CO3产生沉淀和气体,与NaSCN生成血红色溶液,与H2S产生淡黄S沉淀、与AgNO3产生白色沉淀,与C6H5OH显紫色。
答案 C
考点3特殊的除杂方法
特别提醒:在使用常规的方法无法进行除杂操作时,即根据物理方法或化学反应不能将杂质直接除去,可突破定势思维,“一反常规”,将被提纯的物质先转化为其他物质,然后再利用化学反应将其重新还原为被提纯物质,在此过程中杂质即被除去。
[例3] (09届盐城高三联考) 七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
|
pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
|
温度 / ℃ |
10 |
30 |
40 |
50 |
60 |
|
CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
|
MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:
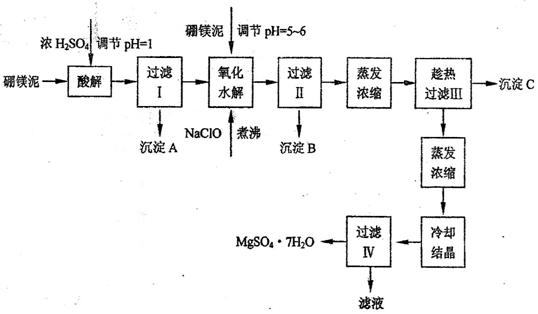
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5-6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 _______ 。加热煮沸的主要目的是_ _______ 。
(2)沉淀B中除MnO2、SiO2外还含有 _______ (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 _______ ;
(4)沉淀C的化学式是 _______ 。过滤II需趁热过滤的理由是 _______
[解析]向硼镁泥中加硫酸时MnO2、SiO2不溶解,PH=5-6时Fe(OH)3 、 Al(OH)3也会沉淀,加热煮沸的主要目的是促进Al3+、Fe3+水解及Mn2+氧化成MnO2 ,由于MgSO4的溶解度不大,温度低时结晶析出,所以过滤II需趁热过滤。
答案:(1)Mn2++ClO-+H2O=MnO2↓+2H++Cl-
促进Al3+、Fe3+水解及Mn2+氧化成MnO2 (2)Fe(OH)3 Al(OH)3
(3)取过滤II后的滤液1-2 ml于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+
(4)CaSO4·2H2O或CaSO4 以防MgSO4在温度低时结晶析出。
7、紫色世界
(1)基态:KMnO4 (H+)、紫色石蕊、碘单质呈紫黑色
(2)激发态:充氩气的灯光呈紫蓝色,钾元素的焰色呈紫色(透过蓝色钴玻璃观察)
(3)化学变化:
①I2 升华生紫烟,
②NH4I受热生紫烟,
③紫色石蕊在(5.0<pH<8.0)溶液中呈紫色,
④锌粉与碘的混合物中滴入水会生紫烟(反应放热使碘升华)
6、蓝色世界
(1)基态:CuSO4 (溶液)、 CuSO4 •5H2O (晶体)、液氧、臭氧
(2)化学变化:
①紫色石蕊在碱性溶液(pH>8)中变蓝,
②润湿的红色石蕊试纸遇碱性气体变蓝,
③无水 CuSO4 (白色粉末)遇水变蓝,
④H2、H2S 、 CH4 、C2H5OH 燃烧火焰呈淡兰色,CO燃烧火焰呈蓝色,
⑤S8在空气中燃烧呈淡蓝色火焰,在纯氧中燃烧呈现明亮的蓝紫色火焰,
⑥淀粉遇 I2 (aq)变蓝,
⑦Cl2 、 Br2 、 NO2 、O3遇湿润的淀粉碘化钾试纸变蓝
5、青色世界
(1)基态:铁粉、银粉及大多数金属粉末、石墨、CuO 、 CuS 、Cu2S FeO 、 Fe3O4 、 MnO2
(2)化学变化:
①蔗糖遇浓硫酸被炭化变黑,
②润湿的白色醋酸铅试纸遇H2S变黑,
③硫磺粉与白色的水银反应生成黑红色的HgS,
④H2S通入Pb(NO3)2 、 AgNO3 、 CuSO4溶液产生不溶于水也不溶于稀盐酸和稀硫酸的黑色沉淀。
4、绿色世界
(1)基态:F2 (浅黄绿色)、Cl2 (黄绿色)、Cu 2(OH)2CO3 (绿色)CuCl2(浓溶液呈绿色)、FeSO4 (浅绿色)
(2)激发态:铜元素的焰色呈绿色
(3)化学变化:Fe (OH)2 (白色)-- 灰绿色--Fe (OH)3(红棕色)
3、黄色世界
(1)基态:工业盐酸(含有 Fe3+)、Au 、 S8 、Na2O2 (淡黄色)、AgBr(淡黄色)、AgI、 Ag3PO4
(2)激发态:钠元素焰色呈黄色
(3)化学变化:
①甲基橙在(pH>4.4)溶液中呈黄色,
②久置的浓硝酸因溶有自身分解产生的二氧化氮而变黄
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com